Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi nMg = nAl = a (mol)
=> 24a + 27a = m
=> 51a = m
PTHH: 2Mg + O2 --to--> 2MgO
a---------------->a
4Al + 3O2 --to--> 2Al2O3
a------------------>0,5a
=> 40a + 51a = m + 2
=> 91a = 51a + 2
=> a = 0,05 (mol)
m = 0,05.24 + 0,05.27 = 2,55 (g)
Các PTHH của phản ứng:
2Mg+O2-->(to) MgO(1)
2mol 1mol 1mol
x mol 0,5mol
4Al+3O2-->(to) 2Al2O3 (2)
4mol 3mol 2mol
xmol 3/4mol
Khối lượng tăng bằng khối lượng của oxi tham gia phản ứng ⇒ mO2 = 2g.
nO2=2/32=0,625(mol)
Vì Mg và Al có số mol bằng nhau. Gọi nMg=nAl = x mol
Từ phương trình (1) và (2) ta có: nO2=0,5x+3/4x=0,625(mol)
=> x= 0,05(mol)
mhh=0,05(27+24) =2,55(g)

Ta có :
$m_{O_2\ pư} = m_{tăng} = 4(gam) \Rightarrow n_{O_2} = \dfrac{4}{32} = 0,125(mol)$
Gọi $n_{Mg} = n_{Al} = a(mol)$
$2Mg + O_2 \xrightarrow{t^o} 2MgO$
$4Al + 3O_2 \xrightarrow{t^o} 2Al_2O_3$
Theo PTHH : $n_{O_2} = 0,5a + 0,75a = 0,125 \Rightarrow a = 0,1(mol)$
$\Rightarrow m = 0,1.24 + 0,1.27 = 5,1(gam)$

Các PTHH của phản ứng:
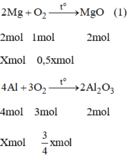
Khối lượng tăng bằng khối lượng của oxi tham gia phản ứng ⇒ m O 2 = 2g.
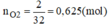
Vì Mg và Al có số mol bằng nhau. Gọi n M g = n A l = x mol
Từ phương trình (1) và (2) ta có:
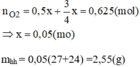

FeO + CO -> Fe + CO2
mol: x -> x
pt2: Fe2O3 + CO ->2 Fe + CO2
mol: y -> 2y
theo gt thu được 2.94 g
Fe trong đó có Fe tạo thành và Fe ban đầu và gọi Z là số mol Fe ban đầu
=> ta có Pt : 72x + 160y +56z=3.54 (1)
và x + 2y + z =3.92/56=0.0525 (2)
hh trên vào CuSO4 thì chỉ có Fe phản ứng
pt: Fe + CuSO4 -> FeSO4 + Cu
mol: z -> z
thu được 3.72g rắn gồm Cu , FeO, Fe2O3
=> ta có pt: 72x + 160y + 64Z=3.72 (3)
từ (1),(2),(3) ta có x=0.015= nFeO , y=0.0075 mol =nFe2O3 , z=0.0225 mol=nFe
Có số mol áp dụng công thức m=n*M em tự tính khối lượng các chất nha
Số ko đẹp lắm nên số mol hơi dài,cứ giữ nguyên để tính để tránh sai số
CHÚC EM HỌC TỐT !!!!!!(nhớ hậu tạ nha hi hi.....)

PTHH: \(2Mg+O_2\underrightarrow{t^o}2MgO\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
\(n_{O_2}=\frac{13,44}{22,4}=0,6\left(mol\right)\)
Đặt số mol Mg là x, số mol Fe là y, ta có hệ:
\(\left\{\begin{matrix}\frac{1}{2}x+\frac{2}{3}y=0,6\\24x+56y=36\end{matrix}\right.\)
giải pt, ta được x=0,8,y=0,3
\(m_{Mg}=0,8.24=19,2g\)
\(m_{Fe}=0,3.56=16,8g\)
\(n_{MgO}=n_{Mg}=0,8mol\)
\(m_{MgO}=0,8.40=32g\)
\(n_{Fe_3O_4}=\frac{1}{3}.n_{Fe}=\frac{1}{3}.0,3=0,1mol\)
\(m_{Fe_3O_4}=0,1.232=23,2g\)
Khối lượng hh thu đc: 32+23,2=55,2g
\(2Mg\left(x\right)+O_2\left(0,5x\right)\rightarrow2MgO\left(x\right)\)
\(3Fe\left(y\right)+2O_2\left(\frac{2y}{3}\right)\rightarrow Fe_3O_4\left(\frac{y}{3}\right)\)
Gọi số mol của Mg, Fe lần lược là x, y thì ta có
\(24x+56y=36\left(1\right)\)
\(n_{O_2}=\frac{13,44}{22,4}=0,6\)
\(\Rightarrow0,5x+\frac{2y}{3}=0,6\left(2\right)\)
Từ (1) và (2) ta có hệ : \(\left\{\begin{matrix}0,5x+\frac{2y}{3}=0,6\\24x+56y=36\end{matrix}\right.\)
\(\Leftrightarrow\left\{\begin{matrix}x=0,8\\y=0,3\end{matrix}\right.\)
\(\Rightarrow m_{Mg}=0,8.24=19,2\)
\(\Rightarrow m_{Fe}=0,3.56=16,8\)
\(\Rightarrow m_{O_2}=0,6.32=19,2\)
\(\Rightarrow m_{hh}=19,2+36=55,2\)

\(n_{Al} = a ; n_{Fe} = b\Rightarrow 27a + 56b = 27,6(1)\\ 4Al + 3O_2 \xrightarrow{t^o} 2Al_2O_3\\ 3Fe + 2O_2 \xrightarrow{t^o} Fe_3O_4\\ n_{Al_2O_3} = \dfrac{1}{2}n_{Al} = 0,5a(mol)\\ n_{Fe_3O_4} = \dfrac{1}{3}n_{Fe} = \dfrac{b}{3}(mol)\\ \Rightarrow 0,5a.102 + \dfrac{b}{3}232 = 43,6(2)\\ (1)(2) \Rightarrow a = 0,4 ; b = 0,3\\ m_{Al} = 0,4.27 = 10,8(gam) ; m_{Fe} = 0,3.56 = 16,8(gam)\)

Cái này sai đề rồi em, anh lập hệ pt mà bấm ra số mol âm
đúng anh à
em ra đc \(n_{Mg}=1,85\left(mol\right);n_{Al}=-\dfrac{16}{15}\left(mol\right)\)

Gọi $n_{Al}= a(mol) ; n_{Fe} = b(mol) \Rightarrow 27a + 56b = 4,44(1)$
$4Al + 3O_2 \xrightarrow{t^o} 2Al_2O_3$
$3Fe + 2O_2 \xrightarrow{t^o} Fe_3O_4$
$Fe_3O_4 + 4H_2 \xrightarrow{t^o} 3Fe + 4H_2O$
B gồm : $Al_2O_3, Fe$
$n_{Al_2O_3} = \dfrac{1}{2}n_{Al} = 0,5a(mol)$
Suy ra: $0,5a.102 + 56b = 5,4(2)$
Từ (1)(2) suy ra a = 0,04 ; b = 0,06
$m_{Al} = 0,04.27 =1,08\ gam$
$m_{Fe} = 0,06.56 = 3,36\ gam$
PTHH: \(2Mg+O_2\underrightarrow{t^o}2MgO\)
\(4Fe+3O_2\underrightarrow{t^o}2Fe_2O_3\)
Giả sử hỗn hợp ban đầu có khối lượng 100 (g)
Gọi số mol Mg, Fe là a, b (mol)
=> 24a + 56b = 100 (1)
Theo PTHH: \(\left\{{}\begin{matrix}n_{MgO}=a\left(mol\right)\\n_{Fe_2O_3}=0,5b\left(mol\right)\end{matrix}\right.\)
mchất rắn sau pư = 40a + 160.0,5b = 100.1,5
=> 40a + 80b = 150 (2)
(1)(2) => a = 1,25 (mol); b = 1,25 (mol)
=> \(\%m_{Mg}=\dfrac{1,25.24}{100}.100\%=30\%\)