cho 13 gam Zn tác dụng với 0,3 mol HCL sau kh kết thức phản ứng thu được muối kẽm Clorua và khí \(H_2\)
a.viết cân bằng phương trình phản ứng và cho biết sau khi kết thúc phản ứng thì chất nào còn dư và nếu dư thì dư với khối lượng bao nhiêu
b.tính thể tích(ở đktc) của \(H_2\) thu được

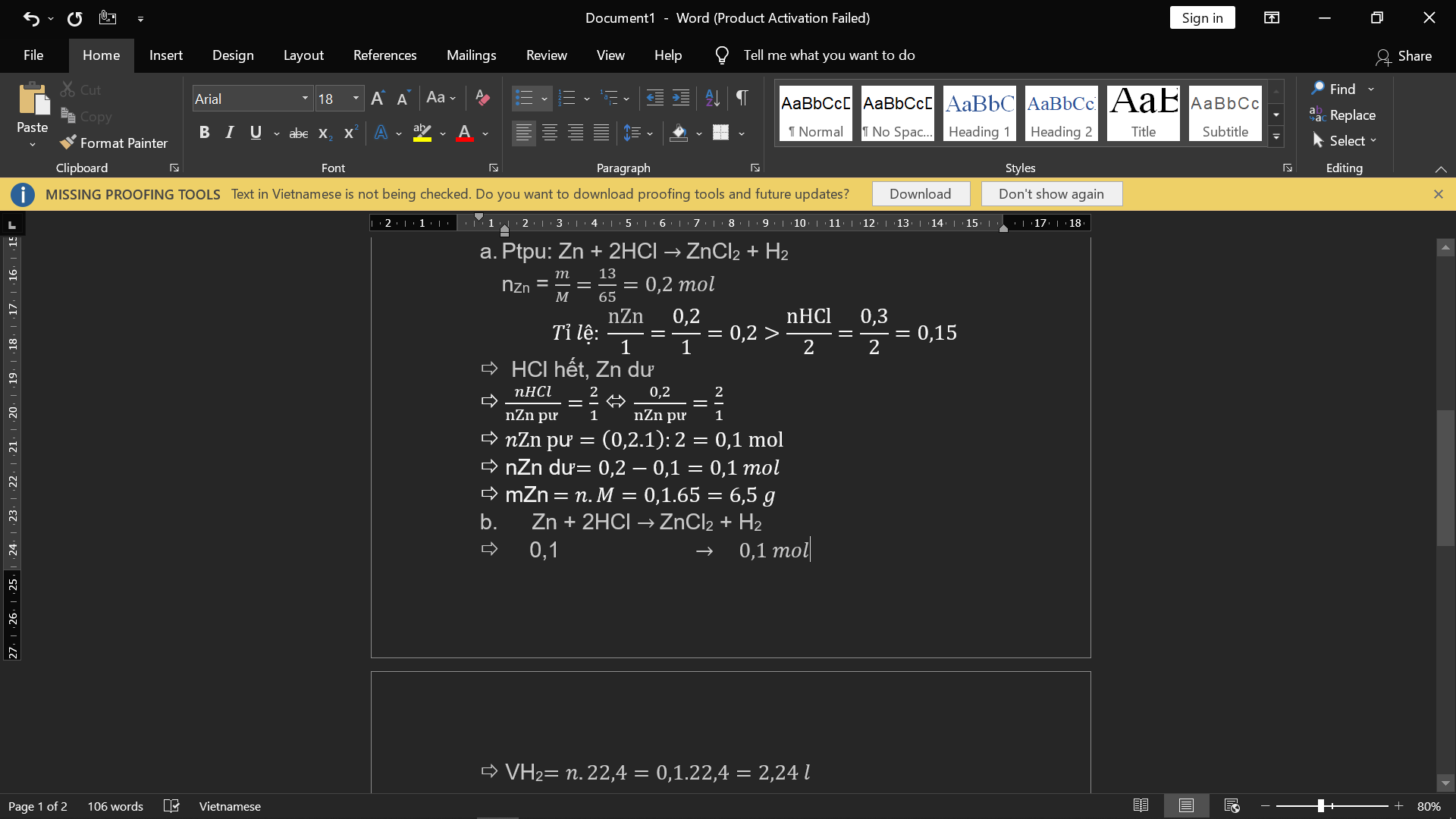
\(a) Zn + 2HCl \to ZnCl_2 + H_2\\ n_{Zn} = \dfrac{13}{65} = 0,2(mol)\\ \dfrac{n_{Zn}}{1} = 0,2 > \dfrac{n_{HCl}}{2} = 0,15 \to Zn\ dư\\ n_{Zn\ pư} = \dfrac{1}{2}n_{HCl} = 0,15(mol)\\ m_{Zn\ dư} = (0,2 - 0,15).65 = 3,25(gam)\\ b) n_{H_2} = n_{Zn\ pư} = 0,15(mol) \Rightarrow V_{H_2} = 0,15.22,4 = 3,36(lít)\)