Khử hoàn toàn 16 gam bột Fe2O3 bằng bột nhôm. Khối lượng bột nhôm cần dùng là?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án : C
Fe2O3 + 2Al -> Al2O3 + 2Fe
=> nAl = 2nFe2O3 = 0,1 mol
=> mAl = 2,7g

Đáp án : A
2Al + Fe2O3 → Al2O3 + 2Fe
0,1 <--- 0,05
=> m Al = 2,7g

a) 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
b) \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
0,2<----0,3<-----------------0,3
=> mAl = 0,2.27 = 5,4 (g)
c) \(m_{dd.H_2SO_4}=\dfrac{0,3.98}{30\%}=98\left(g\right)\)

\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
\(nH_2=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(nH_2SO_4=nH_2=0,15\left(mol\right)\)
\(nH_2SO_{4\left(15\%\right)}=\dfrac{0,15.15}{100}=0,0225\left(mol\right)\)
\(mH_2SO_4=0,0225.98=2,205\left(g\right)\)
\(nAl=\dfrac{2}{3}.0,15=0,1\left(mol\right)\)
\(mAl=0,1.27=2,7\left(g\right)\)
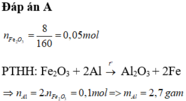
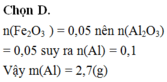
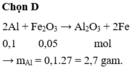
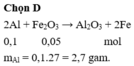

nFe2O3 = 16/160 = 0.1 (mol)
2Al + Fe2O3 -to-> 2Fe + Al2O3
0.2........0.1
mAl = 0.2 * 27 = 5.4 (g)