Hỗn hợp X gồm hai khí metan và etilen (đktc), có tỉ khối so với hiđro bằng 10. Cho 3,36 lít X qua dung dịch Br2 dư, số mol Br2 đã tham gia phản ứng là
A. 0,1. B. 0,05. C. 0,12. D. 0,03.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
V = 5,04l => n = 0,225 mol
n(C2H2) = x
n(H2) = y
m= 26x + 2y
28,5 = (26x+2y)/x
x+y = 0,225
=> x = 0,1mol
y= 0,125 mol
n(liên kết pi) = 0,2 mol
=> n(Br2) = 0,2 - 0,125 = 0,075 mol

a. Phương trình phản ứng giữa axetilen và dung dịch Br2:
C2H2 + Br2 → C2H2Br2
b. Theo định luật Avogadro, số mol khí thể tích bằng nhau ở cùng điều kiện nhiệt độ và áp suất. Vì vậy, số mol của hỗn hợp Y bằng số mol của khí thoát ra sau phản ứng.
Theo đó, ta có thể tính số mol mỗi khí trong hỗn hợp:
Số mol khí thoát ra: n = V/ Vm = 2,24/ 22,4 = 0,1 molSố mol axetilen ban đầu: n(C2H2) = n = 0,1 molSố mol metan ban đầu: n(CH4) = (V(Y) - V(C2H2)) / Vm = (3,36 - 2,24) / 22,4 = 0,05 molc. Để tính % về khối lượng từng khí trong hỗn hợp, ta cần biết khối lượng riêng của từng khí. Ở đktc, khối lượng riêng của axetilen là 1,096 g/L và khối lượng riêng của metan là 0,717 g/L.
Khối lượng axetilen trong hỗn hợp: m(C2H2) = n(C2H2) x M(C2H2) = 0,1 x 26 = 2,6 gKhối lượng metan trong hỗn hợp: m(CH4) = n(CH4) x M(CH4) = 0,05 x 16 = 0,8 gTổng khối lượng của hỗn hợp Y: m(Y) = V(Y) x ρ(Y) = 3,36 x 1,25 = 4,2 gVậy, % về khối lượng của axetilen trong hỗn hợp là:
% m(C2H2) = (m(C2H2) / m(Y)) x 100% = (2,6 / 4,2) x 100% = 61,9%
% về khối lượng của metan trong hỗn hợp là:
% m(CH4) = (m(CH4) / m(Y)) x 100% = (0,8 / 4,2) x 100% = 19,0%

Chọn B
Theo giả thiết và áp dụng bảo toàn nguyên tố H, bảo toàn số liên kết π , ta có


Đáp án B
0,3375 mol hhX gồm C2H2 và H2 qua Ni, to
→ hhY gồm 3 hiđrocacbon, dY/H2 = 14,25.
MY = 28,5 → hhY có CTC là C2H4,5.
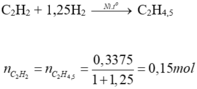
• C2H4,5 + 0,75Br2 → C2H4,5Br1,5
0,15------- 0,1125
→ mBr2 = 0,1125 x 160 = 18 gam