Dẫn 2,24 lít hỗn hợp khí X gồm C2H2 và H2 có tỉ lệ thể tích tương ứng 2 : 3 đi qua Ni nung nóng thu được
hỗn hợp Y, cho Y đi qua dung dịch Br2 dư thu được 896 ml hỗn hợp khí Z bay ra khỏi bình dung dịch Br2.
Tỉ khối của Z đối với H2 bằng 4,5. Biết các khí đều đo ở đktc. Khối lượng bình Br2 tăng thêm là
A. 1,6 gam. B. 0,8 gam. C. 0,4 gam. D. 0,6 gam.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Ta có nC2H2 = 0,04 mol, nH2 = 0,06 mol
Bảo toàn khối lượng → mX = m bình tăng + mZ
→ mbình tăng = 0,04.26 + 0,06.2-4,5.2.0,04 = 0,8 gam

nX = 0,1 mol.
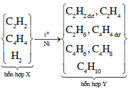
Các phản ứng xảy ra:
![]()
Từ tỉ lệ thể tích tính được
![]()
Khối lượng hỗn hợp đầu
![]()
Khối lượng khí thoát ra
![]()
Áp dụng định luật bảo toàn khối lượng ta có:
![]()
Khối lượng bình brom tăng thêm
m1 =m~ m2 = 1,16 - 0,36 = 0,8 gam
Đáp án B.

Đáp án A
ó Xử lí nhanh quá trình các phản ứng xảy ra:
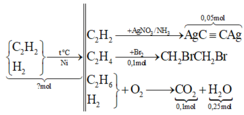
12 gam kết tủa là A g C ≡ C A g ⇄ 0 , 02 m o l C 2 H 2 ∥ c ó 0 , 1 m o l B r 2 ⇄ 0 , 1 m o l C 2 H 4 bị giữ lại ở đây.
ó Quan sát sự đặc biệt của nguyên tố H trong hỗn hợp ban đầu (C2H2 và H2)
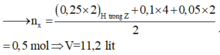

Đáp án B
Bảo toàn khối lượng luôn có :
mX = mY và mY = mZ + Δm.
mX = 15.2. 2,24/22,4= 3 (gam) và mZ = 20.2.0,56/22,4 = 1 (gam).
=> Δm = mY – mZ = 3 – 1 = 2 (gam).

Đáp án B
Bảo toàn khối lượng luôn có :
mX = mY và mY = mZ + Δm.
mX = 15.2. 2,24/22,4= 3 (gam) và mZ = 20.2.0,56/22,4 = 1 (gam).
=> Δm = mY – mZ = 3 – 1 = 2 (gam).

Đáp án B
Bảo toàn khối lượng luôn có :
mX = mY và mY = mZ + Δm.
mX = 15.2. 2,24/22,4= 3 (gam) và mZ = 20.2.0,56/22,4 = 1 (gam).
=> Δm = mY – mZ = 3 – 1 = 2 (gam).
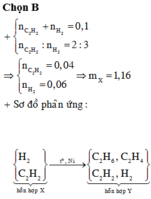
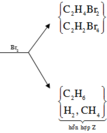
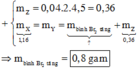

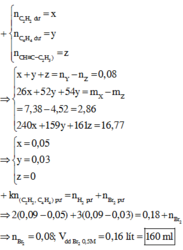

\(\left\{{}\begin{matrix}n_{C_2H_2}+n_{H_2}=\dfrac{2,24}{22,4}\\\dfrac{n_{C_2H_2}}{n_{H_2}}=\dfrac{2}{3}\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}n_{C_2H_2}=0,04\\n_{H_2}=0,06\end{matrix}\right.\)
\(m_Z=4,5\cdot2\cdot0,04=0,36g\)
BTKL: \(m_X=m_{bìnhtăng}+m_Z\)
\(\Rightarrow0,04\cdot26+0,06\cdot2=m_{bìnhtăng}+0,36\)
\(\Rightarrow m_{bìnhtăng}=0,8g\)
Chọn B