Cho 8g oxit của một kim loại hóa trị III tác dụng vừa đủ với 150ml dung dịch H2SO4 1M. Tìm công thức của oxit.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi A là kim loại có mặt trong oxit cần tìm
\(PTHH:AO+H_2SO_4\rightarrow ASO_4+H_2O\\ n_{H_2SO_4}=\dfrac{100.9,8\%}{98}=0,1\left(mol\right)\\ n_{AO}=n_{H_2SO_4}=0,1\left(mol\right)\\ M_{AO}=\dfrac{8}{0,1}=80\left(\dfrac{g}{mol}\right)=M_A+16\\ \Rightarrow M_A=64\left(\dfrac{g}{mol}\right)\\ \Rightarrow Oxit.AO:CuO\)
Gọi cthh của oxit kim loại hóa trị II là RO.
RO + H2SO4 --> RSO4 + H2O (1)
mH2SO4 = 9,8%.100 = 9,8 (g)
-> nH2SO4 = 9,8/98 = 0,1 (mol)
nRO = 8/R+16 (mol)
Từ (1) -> nRO = nH2SO4 = 0,1mol
-> 8/R+16 = 0,1 -> R = 64 -> R là Cu

Đáp án A
Số mol của H 2 SO 4 là: n H 2 SO 4 = 0 , 5 . 1 = 0 , 5 mol
Đặt công thức của oxit kim loại hóa trị II là MO
Phương trình hóa học:
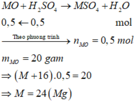
=> Oxit là MgO

Ta có: \(C_{\%_{H_2SO_4}}=\dfrac{m_{H_2SO_4}}{200}.100\%=7,35\%\)
=> \(m_{H_2SO_4}=14,7\left(g\right)\)
=> \(n_{H_2SO_4}=\dfrac{14,7}{98}=0,15\left(mol\right)\)
Gọi oxit kim loại là: MO
PTHH: MO + H2SO4 ---> MSO4 + H2O
Theo PT: \(n_{MO}=n_{H_2SO_4}=0,15\left(mol\right)\)
=> \(M_{MO}=\dfrac{6}{0,15}=40\left(g\right)\)
Ta có: \(M_{MO}=NTK_M+16=40\left(g\right)\)
=> \(NTK_M=24\left(đvC\right)\)
Dựa vào bảng hóa trị, suy ra:
M là Mg
=> Oxit kim loại có CTHH là: MgO
Chon B. MgO

\(n_{H_2SO_4}=\dfrac{147.20\%}{98}=0,3\left(mol\right)\\ Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ n_{H_2}=n_{axit}=0,3\left(mol\right)\\ Đặt:A_2O_3\\ A_2O_3+3H_2\rightarrow\left(t^o\right)2A+3H_2O\\ n_{oxit}=\dfrac{n_{H_2}}{3}=\dfrac{0,3}{3}=0,1\left(mol\right)\\ M_{oxit}=\dfrac{16}{0,1}=160\left(\dfrac{g}{mol}\right)=2M_A+48\\ \Rightarrow M_A=56\left(\dfrac{g}{mol}\right)\\ \Rightarrow A:Sắt\left(Fe=56\right)\\ \Rightarrow Oxit:Fe_2O_3\)

Ta có: \(n_{HCl}=\dfrac{100}{1000}.3=0,3\left(mol\right)\)
\(PTHH:\)
\(A_2O_3+6HCl--->2ACl_3+3H_2O\left(1\right)\)
Theo PT(1): \(n_{A_2O_3}=\dfrac{1}{6}.n_{HCl}=\dfrac{1}{6}.0,3=0,05\left(mol\right)\)
\(\Rightarrow M_{A_2O_3}=\dfrac{5,1}{0,05}=102\left(\dfrac{g}{mol}\right)\)
Mà: \(M_{A_2O_3}=2A+16.3=102\left(\dfrac{g}{mol}\right)\)
\(\Leftrightarrow A=27\left(\dfrac{g}{mol}\right)\)
Vậy A là nhôm (Al)
\(PTHH:Al_2O_3+3H_2SO_4--->Al_2\left(SO_4\right)_3+3H_2O\left(2\right)\)
Theo PT(2): \(n_{H_2SO_4}=3.n_{Al_2O_3}=3.0,05=0,15\left(mol\right)\)
Mà: \(C_{\%_{H_2SO_4}}=\dfrac{0,15.98}{m_{dd_{H_2SO_4}}}.100\%=25\%\)
\(\Leftrightarrow m_{dd_{H_2SO_4}}=58,8\left(g\right)\)
Gọi công thức của oxit là A2O3
Ta có A2O3 + 6HCl → 2ACl3 + 3H2O
Từ pthh ta có nA2O3 = 1/6 nHCl = 1/6 . 0,3 = 0,05 mol
=> MA2O3 = mA2O3 : nA2O3 = 5,1 : 0,05 = 102
MA2O3 = 2 . MA + 3 . 16 = 2MA + 48 = 102
=> MA = 27 => A là nhôm
=>Al2O3+3H2SO4->Al2(SO4)3+3H2O
0,05-----0,15 mol
=>m dd H2SO4=58,8g

Gọi hóa trị của kim loại M là x
PTHH: M2Ox + 2xHCl ===> 2MClx + xH2
Số mol HCl: nHCl = 1,5 x 0,2 = 0,3 (mol)
Theo PTHH, nM2Ox = 0,3/2x=0,15/x(mol)
⇒ MM2Ox = 8÷0,15/x=160x/3(g/mol)
⇔2MM+16x=160x/3
⇔2MM=160x/3−16x=112x/3
⇔MM=56x/3(g/mol)
Vì M là kim loại nên x nhận các giá trị 1, 2,3
+) x = 1 ⇒ MM = 563(loại)
+) x = 2 ⇒ MM = 1123(loại)
+) x = 3 ⇒ MM = 56 (nhận)
⇒ M là Fe
⇒ Công thức oxit: Fe2O3

gọi công thức của kim loại là M có khối lượng mol nguyên tử là M
\(n_{H_2SO_4}=0,2\cdot1=0,2\left(mol\right)\)
\(M+H_2SO_4\rightarrow MSO_4+H_2\uparrow\)
1---------1
0,2------0,2
=> 0,2M = 8
=> M = \(\dfrac{8}{0,2}\) = 40 (g/mol)
vậy M là kim loại Canxi

1) Gọi công thức của oxit là AO. Số mol HCl là 0,4.1=0,4 (mol).
AO (0,2 mol) + 2HCl (0,4 mol) \(\rightarrow\) ACl2 + H2\(\uparrow\).
Phân tử khối của oxit là 8,0/0,2=40 (g/mol).
Vậy A là magie (Mg) và công thức hóa học của oxit là MgO.
2) Số mol MgCO3 và H2SO4 lần lượt là 8,4/84=0,1 (mol) và 0,5.1=0,5 (mol).
Các chất tan trong dung dịch sau phản ứng gồm MgSO4 (0,1 mol) và H2SO4 dư (0,4 mol) có nồng độ mol lần lượt là 0,1/0,5=0,2 (M) và 0,4/0,5=0,8 (M).
\(1,n_{HCl}=0,4.1=0,4\left(mol\right)\\ PTHH:AO+2HCl\rightarrow ACl_2+H_2O\\ Mol:0,2\leftarrow0,4\\ M_{AO}=\dfrac{8}{0,2}=40\left(\dfrac{g}{mol}\right)\\ \Leftrightarrow A+16=40\\ \Leftrightarrow A=24\left(\dfrac{g}{mol}\right)\\ \Leftrightarrow A.là.Mg\\ CTHH:MgO\)
\(2,n_{H_2SO_4}=1.0,5=0,5\left(mol\right)\\ PTHH:MgCO_3+H_2SO_4\rightarrow MgSO_4+CO_2\uparrow+H_2O\\ Mol:0,5\leftarrow0,5\rightarrow0,5\\ C_{M\left(MgSO_4\right)}=\dfrac{0,5}{0,5}=1M\)
\(A_2O_3+3H_2SO_4\rightarrow3H_2O+A_2\left(SO_4\right)_3\)
mol 0,05 0,15
\(N_{H_2SO_4}=1.0,15=0,15\left(mol\right)\)
\(N_{A_2O_3}=\frac{0,15}{3}=0,05\left(mol\right)\)
\(M_{A_2O_3}=\frac{8}{0,05}=160\left(g\right)\)
=>\(2A+16.3=160\)
<=>\(2A=112\)
<=>\(A=56\)=> A là Fe
Vậy CT là \(Fe_2O_3\)