Cho hỗn hợp Fe và FeS vào dung dịch HCl (dư) thu được 2,24 lít hỗn hợp khí (ở đktc) có tỉ khối so với H2 là 9. Thành phần % số mol của Fe trong hỗn hợp trên là:
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi số mol H2, H2S là a, b (mol)
\(\left\{{}\begin{matrix}a+b=\dfrac{2,24}{22,4}=0,1\\M=\dfrac{2a+34b}{a+b}=9.2=18\left(g/mol\right)\end{matrix}\right.\)
=> a = 0,05 (mol); b = 0,05 (mol)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,05<-------------------0,05
FeS + 2HCl --> FeCl2 + H2S
0,05<---------------------0,05
=> \(\%n_{Fe}=\%n_{FeS}=\dfrac{0,05}{0,05+0,05}.100\%=50\%\)
\(M_{hhkhí}=9.2=18\left(g\text{/}mol\right)\\ n_{hhkhí}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Áp dụng sơ đồ đường chéo, ta có:
\(\dfrac{n_{H_2S}}{n_{H_2}}=\dfrac{V_{H_2S}}{V_{H_2}}=\dfrac{34-18}{18-2}=\dfrac{1}{1}\)
\(\rightarrow n_{H_2S}=n_{H_2}=\dfrac{0,1}{2}=0,05\left(mol\right)\)
PTHH:
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
0,05<-----------------------0,05
\(FeS+2HCl\rightarrow FeCl_2+H_2S\uparrow\)
0,05<-------------------------0,05
\(\rightarrow\left\{{}\begin{matrix}\%n_{Fe}=\dfrac{0,05}{0,05+0,05}.100\%=50\%\\\%n_{FeS}=100\%-50\%=50\%\end{matrix}\right.\)

Đáp án C
Đặt số mol các chất trong hỗn hợp X là Fe: a mol; FeS: b mol
Các phương trình hóa học:
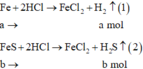
=> Y gồm H2: a mol; H2S : b mol
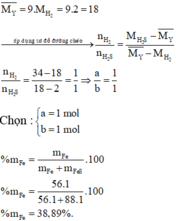

\(n_{PbS}=\dfrac{47,8}{239}=0,2\left(mol\right)\)
Bảo toàn S: \(n_{FeS}=n_{H_2S}=0,2\left(mol\right)\)
\(n_{H_2}=\dfrac{6,72}{22,4}-0,2=0,1\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,1<----------------------0,1
=> mFe = 0,1.56 = 5,6 (g)
mFeS = 0,2.88 = 17,6 (g)
\(\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{5,6}{5,6+17,6}.100\%=24,138\%\\\%m_{FeS}=\dfrac{17,6}{5,6+17,6}.100\%=75,862\%\end{matrix}\right.\)

\(n_{hhkhí\left(H_2,H_2S\right)}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{FeS}=b\left(mol\right)\end{matrix}\right.\)
PTHH:
Fe + 2HCl ---> FeCl2 + H2
a a
FeS + 2HCl ---> FeCl2 + H2S
b b
Hệ pt \(\left\{{}\begin{matrix}56a+88b=7,2\\a+b=0,1\end{matrix}\right.\Leftrightarrow a=b=0,05\left(mol\right)\)
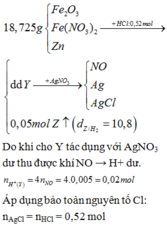







\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
\(FeS+2HCl\rightarrow FeCl_2+H_2S\uparrow\)
Đặt nH2 = x mol; nH2S = y mol
Ta có: nkhí = x + y = 0,1 mol;
mkhí = 2x + 34y = 0,1.9.2 = 1,8 gam
Giải hệ ta có: x = 0,05 và y = 0,05
Suy ra nFe = 0,05. nFeS = 0,05 mol.
Vậy %nFe = 50%.
\(n_{\uparrow}=\dfrac{2,24}{22,4}=0,1mol\)
Gọi \(\left\{{}\begin{matrix}n_{Fe}=x\left(mol\right)\\n_{FeS}=y\left(mol\right)\end{matrix}\right.\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
\(FeS+2HCl\rightarrow FeCl_2+H_2S\uparrow\)
\(\Rightarrow x+y=0,1\left(1\right)\)
\(d_{\uparrow}\)/H2=9\(\Rightarrow\overline{M_{\uparrow}}=9\cdot2=18\)
Sơ đồ chéo:
Fe 56 70
18
FeS 88 38
\(\Rightarrow\dfrac{n_{Fe}}{n_{FeS}}=\dfrac{70}{38}=\dfrac{35}{19}=\dfrac{x}{y}\)(2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=\dfrac{7}{108}\\y=\dfrac{19}{540}\end{matrix}\right.\)
\(\%Fe=\dfrac{\dfrac{7}{108}}{\dfrac{7}{108}+\dfrac{19}{540}}\cdot100\%=64,81\%\)