Đốt cháy hoàn toàn m gam hai hiđrocacbon X và Y dùng vừa đủ 13,44 lít O2 (đktc), thu được
CO2 và 7,2 gam H2O. Giá trị của m là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : A
nCO2 = nH2O => Xeton no, đơn chức, mạch hở, anken đơn chức
Bảo toàn nguyên tố
=> nX = nO (trong X) = 2nCO2 + nH2O - 2nO2 = 0,1 mol
=> Số nguyên tử C trong X < 0,4/0,1 = 4
=> X là axeton

Đáp án B
Dựa trên phản ứng đốt cháy tổng quát của cacbohiđrat:
![]()
Bạn có thể thấy ngay:
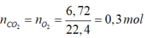
Bảo toàn khối lượng:
![]()

Đặt \(\left\{{}\begin{matrix}n_{CO_2}=a\left(mol\right)\\n_{H_2O}=b\left(mol\right)\end{matrix}\right.\)
Ta thấy các chất đều có công thức CnH2n+2O \(\Rightarrow n_{O\left(hỗnhợp\right)}=n_{H_2O}-n_{CO_2}\)
\(\Rightarrow n_{O\left(ancol\right)}=b-a\)
Ta có: \(m_{hh}=m_C+m_H+m_O=9,2\left(g\right)\) \(\Rightarrow a+2b+16\left(b-a\right)=9,2\) (1)
Mặt khác: \(n_{O_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
Bảo toàn oxi: \(\left(b-a\right)+2\cdot0,6=2a+b\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=n_{CO_2}=0,4\left(mol\right)\\b=n_{H_2O}=\dfrac{38}{45}\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{CO_2}=0,4\cdot22,4=8,96\left(l\right)\\m_{H_2O}=15,2\left(g\right)\end{matrix}\right.\)

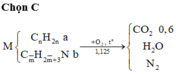
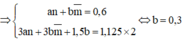
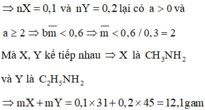


n O2=\(\dfrac{13,44}{22,4}\)=0,6 mol
=>n H2O=\(\dfrac{7,2}{18}\)=0,4 mol =>n H=0,8 mol
=>n CO2=0,8 mol=>n C=0,8 mol
m =0,8.1+0,8.12=10,4g
n O2=\(\dfrac{13,44}{22,4}\)=0,6 mol
=>n H2O=\(\dfrac{7,2}{18}\)=0,4 mol =>n H=0,8 mol
=>n CO2=0,2 mol=>n C=0,2 mol
m =0,8+0,2.12=3,2g