Hòa tan 5,6g oxit kim loại hóa trị (II) vào nước thu được 7,4g bazơ.Tìm kim loại
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi công thức hóa học của oxit là RO
→Phương trình hóa học: RO+2HCl→RCl2+H2O
nRO:8,1\(R+16nRO)= nRCl2: 13,6\R+35,5.2
⇔ 8,1.(R+71)=13,6.(R+16)
⇔ 8,1R+575,1=13,6R+217,6
⇔ 8,1R−13,6R=−575,1+217,6
⇔ −5,5R=−357,5
⇔ R=65 (Zn)
→ R là nguyên tố Kẽm (Zn)
công thức hóa học: ZnO

Chọn C
Gọi công thức của oxit hóa trị II là RO
Đặt mol RO = 1 (mol)
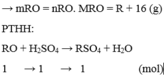
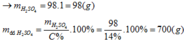
![]()
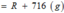
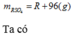

Vậy công thức của oxit kim loại là MgO
Hòa tan 9,4g một oxit kim loại hóa trị I vào H2O, thu được 200ml dung dịch Bazơ 1M.
Tìm oxit kim loại

PTHH: A2O + H2O → 2AOH
\(n_{AOH}\) = 0,2 ×1=0,2 ( mol ) ( vì 200 ml = 0,2 l )
Theo PT: \(n_{A_2O}=\dfrac{1}{2}n_{AOH}=\) = 12 × 0,2 = 0,1 ( mol )
⇒ \(M_{A_2O}=\dfrac{9,4}{0,1}=94\) ( G )
Ta có: 2\(M_A\) + 16 = 94
⇔ 2\(M_A\)= 78
⇔ \(M_A\) =39 ( g )
Vậy A là kim loại Kali K

nH2=2,24/22,4=0,1(mol)
PTHH: X + 2 HCl -> XCl2 + H2
Ta có: nX=nXCl2=nH2=0,1(mol)
=> M(X)=mX/nX=5,6/0,1=56(g/mol)
=>XCl2 là FeCl2
=> m(muối)=mFeCl2=127.0,1=12,7(g)

\(n_{H_2SO_4}=\dfrac{40\cdot49\%}{98}=0.2\left(mol\right)\)
\(AO+H_2SO_4\rightarrow ASO_4+H_2O\)
\(0.2.........0.2\)
\(M=\dfrac{16.2}{0.2}=81\left(\dfrac{g}{mol}\right)\)
\(\Rightarrow A=81-16=65\)
\(CT:ZnO\)

Oxit kim loại : RO
\(RO + 2HNO_3 \to R(NO_3)_2 + H_2O\)
Theo PTHH :
\(n_{RO} = n_{R(NO_3)_2}\\ \Rightarrow \dfrac{2}{R+16} = \dfrac{4,7}{R+62.2} \Rightarrow R = 64(Cu)\)
Oxit cần tìm :CuO
Gọi oxit kim loại cần tìm là RO
\(n_{RO}=\dfrac{5,6}{M_R+16}\left(mol\right)\)
PTHH: RO + H2O --> R(OH)2
\(\dfrac{5,6}{M_R+16}\)---------->\(\dfrac{5,6}{M_R+16}\)
=> \(M_{R\left(OH\right)_2}=M_R+34=\dfrac{7,4}{\dfrac{5,6}{M_R+16}}=\dfrac{37}{28}\left(M_R+16\right)\left(g/mol\right)\)
=> MR = 40 (g/mol)
=> Kim loại là Ca