Bài 3: Hỗn hợp khí X gồm: NO2, CH4 và khí Y (là đơn chất chưa biết). Tỉ khối của X đối với hiđro là 15. Trong hỗn hợp X, CH4 chiếm 16% về khối lượng. Khí Y chiếm 50% về thể tích. Tổng số phân tử trong hỗn hợp X là 6.1023 phân tử.
a/ Tìm CTHH của khí Y. Cho biết Y là khí nào?
b/ Lượng khí Y có trong hỗn hợp trên có đủ để đốt cháy hết 6,72 lít khí CH4 (đktc) không?



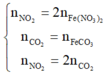

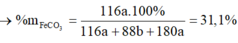
a) \(n_X=\dfrac{6.10^{23}}{6.10^{23}}=1\left(mol\right)\)
=> \(n_Y=0,5\left(mol\right)\)
Gọi số mol NO2, CH4 là a, b
=> a + b = 0,5
Có: \(\dfrac{46a+16b+0,5.M_Y}{1}=15.2\)
=> 46a + 16b + 0,5.MY = 30
Có: \(\dfrac{16b}{46a+16b+0,5.M_Y}.100\%=16\%\)
=> b = 0,3 (mol)
=> a = 0,2 (mol)
=> MY = 32(g/mol)
Mà Y là đơn chất
=> Y là O2
b) \(n_{CH_4}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,5}{2}\)=> CH4 dư, O2 hết
=> Lượng O2 trong hỗn hợp trên không đủ để đốt cháy 6,72 lít CH4
no2 vs ch4 đã có M =60 r