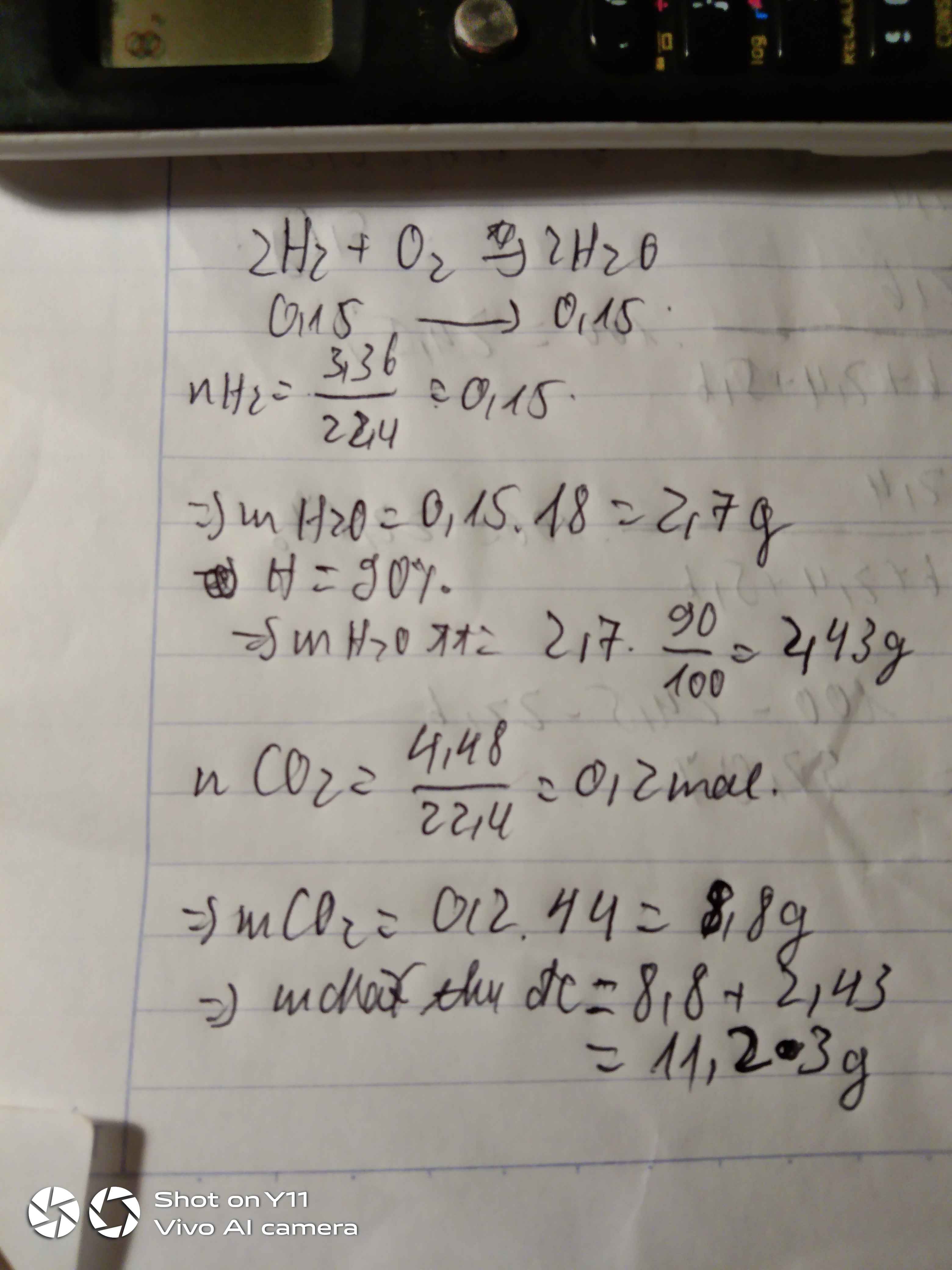Cho 12 g CaCO3 phản ứng với 7,8 g và 4 l khí Cl2 ở điều kiện tiêu chuẩn thì thu được 26,64gCaCl2 hiệu suất của phản ứng là bao nhiêu? a)95% b)90% c)85% d)80%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án C
nNaCl = ![]() = 0,3 mol
= 0,3 mol
2NaCl + H2SO4 → Na2SO4 + 2HCl
0,3 (mol) → 0,3 (mol)
H% = 90% => nHCl = 0,3.![]() = 0,27 (mol)
= 0,27 (mol)
VHCl = 0,27.22,4 = 6,048 (lít)

Ta có: \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
____0,2_____0,4_____0,2____0,2 (mol)
a, \(V_{H_2}=0,2.24,79=4,958\left(l\right)\)
b, mZnCl2 = 0,2.136 = 27,2 (g)
c, Đề cho VTT > VLT nên bạn xem lại đề nhé.

Đề bài phải là thể tích CO2 bạn nhé!
a, PT: \(CaCO_3+2HCl\rightarrow CaCl_2+H_2O+CO_2\)
Ta có: \(n_{CaCO_3}=\dfrac{4}{100}=0,04\left(mol\right)\)
\(m_{HCl}=\dfrac{14,6.25}{100}=3,65\left(g\right)\Rightarrow n_{HCl}=\dfrac{3,65}{36,5}=0,1\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,04}{1}< \dfrac{0,1}{2}\), ta được HCl dư.
Theo PT: \(n_{CO_2}=n_{CaCO_3}=0,04\left(mol\right)\)
\(\Rightarrow V_{CO_2}=0,04.22,4=0,896\left(l\right)\)
b, Theo PT: \(\left\{{}\begin{matrix}n_{HCl\left(pư\right)}=2n_{CaCO_3}=0,08\left(mol\right)\\n_{CaCl_2}=n_{CaCO_3}=0,04\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{HCl\left(dư\right)}=0,02\left(mol\right)\Rightarrow m_{HCl\left(dư\right)}=0,02.36,5=0,73\left(g\right)\)
\(m_{CaCl_2}=0,04.111=4,44\left(g\right)\)
Bạn tham khảo nhé!
PTHH: \(CaCO_3+2HCl\rightarrow CaCl_2+H_2O+CO_2\uparrow\)
Ta có: \(\left\{{}\begin{matrix}n_{CaCO_3}=\dfrac{4}{100}=0,04\left(mol\right)\\n_{HCl}=\dfrac{14,6\cdot25\%}{36,5}=0,1\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,04}{1}< \dfrac{0,1}{2}\) \(\Rightarrow\) HCl còn dư, CaCO3 p/ứ hết
\(\Rightarrow\left\{{}\begin{matrix}n_{CO_2}=n_{CaCl_2}=0,04\left(mol\right)\\n_{HCl\left(dư\right)}=0,02\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{CO_2}=0,04\cdot22,4=0,896\left(l\right)\\m_{CaCl_2}=0,04\cdot111=4,44\left(g\right)\\m_{HCl\left(dư\right)}=0,02\cdot36,5=0,73\left(g\right)\end{matrix}\right.\)

Ta có: nKClO3 = 61,25 : 122,5 = 0,5 mol
nKMnO4 = 61,25 : 158 = 0,388 mol
Phương trình phản ứng: 2KMnO4 (dấu mũi tên có nhiệt độ nha bạn) K2MnO4 + MnO2 + O2
2 mol 1 mol
0,388 mol x mol
=> x = 0,388 x 1 : 2 = 0,194 mol
=> VO2 = 0,194 x 22,4 = 4,3456 l
Thực tế: VO2 chỉ thu được: HSP = Vthực tế : Vlt x 100
=> VO2 thực tế = Vlt x HSP : 100 = 4,3456 x 95 : 100 = 4,128 l
PTPƯ: 2KClO3 (dấu mũi tên có nhiệt độ) 2KCl + 3O2
2 mol 3 mol
0,5 mol y mol
=> y = 0,5 x 3 : 2 = 0,75 mol
VO2 lt =0,75 x 22,4 = 16,8 l
VO2 tt = 16,8 x 95 : 100 = 15,96 l

\(n_{Mg}=\dfrac{3,12}{24}=0,13\left(mol\right)\)
\(n_{H_2}=\dfrac{2,2311}{25,79}=0,09\left(mol\right)\)
PTHH :
\(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
0,09 0,18 0,09 0,09
\(\dfrac{0,13}{1}>\dfrac{0,09}{1}\) --> Mg dư
\(m_{MgCl_2}=0,09.95=8,55\left(g\right)\)
PTHH :
\(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
0,13 0,26 0,13 0,13
\(V_{H_2\left(lt\right)}=0,13.24,79=3,2227\left(l\right)\)
\(H=\dfrac{2,2311}{3,2227}.100\%\approx69,23\%\)

Fe+2HCl->FeCl2+H2
0,02-0,04--------------0,02
Fe2O3+6HCl->2Fecl3+3H2O
0,03-----0,18 mol
n H2=\(\dfrac{0,448}{22,4}\)=0,02 mol
=>m Fe=0,02.56=1,12g
=>m Fe2O3=4,8g=>n Fe2O3=\(\dfrac{4,8}{160}\)=0,03 mol
=>x=CMHCl=\(\dfrac{0,22}{0,5}\)=0,44M
b)
2Fe+3Cl2-to>2FeCl3
0,02---0,03
=>m Cl2=0,03.71=2,13g

1. a) PTHH: \(2KClO_3=2KCl+3O_2\)
b) Khối lượng \(KClO_3\) thực tế phản ứng:
\(H=\dfrac{m_{tt}}{m_{lt}}.100\%\Rightarrow m_{tt}=\dfrac{m_{lt}.H}{100\%}=11,025\left(g\right)\)
\(n_{KClO_3}=\dfrac{m_{KClO_3}}{M_{KClO_3}}=\dfrac{11,025}{122,5}=0,09\left(mol\right)\)
Theo PTHH: \(n_{O_2}=\dfrac{0,09.3}{2}=0,135\left(mol\right)\)
\(\Rightarrow V_{O_2}=n_{O_2}.22,4=0,135.22,4=3,024\left(l\right)\)
c) \(4Fe+3O_2\xrightarrow[t^o]{}2Fe_2O_3\)
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
Theo PTHH: \(n_{Fe_2O_3}=\dfrac{0,1.2}{4}=0,05\left(mol\right)\)
\(\Rightarrow m_{Fe_2O_3}=n_{Fe_2O_3}.M_{Fe_2O_3}=0,05.160=8\left(g\right)\)
a)Ta có PTHH: 2KClO3 --t---> 2KCl + 3O2 (1)
b) Biết mKClO3 =12,25g => nKClO3 = mKClO3/MKClO3
=12,25/122,5=0,1 (mol)
Theo PT (1) ta có:
no2 =3/2 nKCLO3 =3/2 . 0,1= 0,15(mol)
Vậy VO2 = n . 22,4 = 0,15 . 22,4= 3,36 (L)
c) Ta có PTHH: 4Fe + 3O2 -----> 2Fe2O3 (2)
Biết mFe = 5,6 g => nFe = m/M= 5,6/56=0,1 (mol)
Theo PT (2) ta có :
nFe2O3 = 2/4 nFe = 2/4 .0,1=0,05 (mol)
Vậy mFe2O3 = n . M = 0,05 . 160= 8 (g)

\(n_{HCl}=\dfrac{18.25}{36.5}=0.5\left(mol\right)\)
\(a.Mg+2HCl\rightarrow MgCl_2+H_2\)
\(b.\)
\(n_{Mg}=n_{H_2}=\dfrac{1}{2}\cdot n_{HCl}=\dfrac{1}{2}\cdot0.5=0.25\left(mol\right)\)
\(m_{Mg}=0.25\cdot24=6\left(g\right)\)
\(V_{H_2}=0.25\cdot22.4=5.6\left(l\right)\)
\(c.\)
\(V_{H_2\left(tt\right)}=5.6\cdot90\%=5.04\left(l\right)\)