Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : B
nOleum = 0,15 mol
=> Sau khi hòa tan Oleum vào dung dịch thì :
mH2SO4 = mH2SO4 trong dd ban đầu + mH2SO4 (Oleum)
= 100.30% + 98.3.0,15 = 74,1g

\(n_{CuO}=\dfrac{4}{80}=0,05\left(mol\right)\)
\(m_{H_2SO_4}=100.9,8\%=9,8\left(g\right)\Rightarrow n_{H_2SO_4}=\dfrac{9,8}{98}=0,1\left(mol\right)\)
PTHH: CuO + H2SO4 → CuSO4 + H2O
Mol: 0,05 0,05 0,05
Ta có: \(\dfrac{0,05}{1}< \dfrac{0,1}{1}\) ⇒ CuO hết, H2SO4 dư
\(C\%_{ddCuSO_4}=\dfrac{0,05.160.100\%}{4+100}=7,69\%\)
\(C\%_{ddH_2SO_4dư}=\dfrac{\left(0,1-0,05\right).98.100\%}{4+100}=4,71\%\)

\(n_{CuO}=\dfrac{4}{80}=0,05\left(mol\right)\)
\(m_{ct}=\dfrac{9,8.100}{100}=9,8\left(g\right)\)
\(n_{H2SO4}=\dfrac{9,8}{98}=0,1\left(mol\right)\)
Pt : \(CuO+H_2SO_4\rightarrow CuSO_4+H_2O|\)
1 1 1 1
0,05 0,1 0,05
Lập tỉ số so sánh : \(\dfrac{0,05}{1}< \dfrac{0,1}{1}\)
⇒ CuO phản ừng hết , H2SO4 dư
⇒ Tính toán dựa vào số mol của CuO
\(n_{CuSO4}=\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
⇒ \(m_{CuSO4}=0,05.160=8\left(g\right)\)
\(n_{H2SO4\left(dư\right)}=0,1-0,05=0,05\left(mol\right)\)
⇒ \(m_{H2SO4\left(dư\right)}=0,05.98=4,9\left(g\right)\)
\(m_{ddspu}=4+100=104\left(g\right)\)
\(C_{CuSO4}=\dfrac{8.100}{104}=7,69\)0/0
\(C_{H2SO4\left(dư\right)}=\dfrac{4,9.100}{104}=4,71\)0/0
Chúc bạn học tốt

Bài 1 :
\(n_{H_2}=\dfrac{2.24}{22.4}=0.1\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(0.1..................................0.1\)
\(m_{hh}=x=0.1\cdot56+4.4=10\left(g\right)\)
Bài 2 :
\(n_{H_2}=\dfrac{2.24}{22.4}=0.1\left(mol\right)\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(0.1.......0.1..........0.1.............0.1\)
\(m_{Fe_2O_3}=7.2-0.1\cdot56=1.6\)
\(n_{Fe_2O_3}=\dfrac{7.2-0.1\cdot56}{160}=0.01\left(mol\right)\)
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
\(0.01...........0.03..............0.01\)
\(c.\)
\(V_{dd_{H_2SO_4}}=\dfrac{0.1+0.03}{1}=0.13\left(l\right)\)
\(d.\)
\(C_{M_{FeSO_4}}=\dfrac{0.1}{0.13}=\dfrac{10}{13}\left(M\right)\)
\(C_{M_{Fe_2\left(SO_4\right)_3}}=\dfrac{0.03}{0.13}=\dfrac{3}{13}\left(M\right)\)
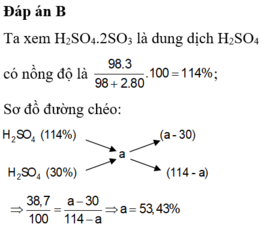
\(m_{dung\ dịch\ sau\ pư} = m_{oleum} + m_{dd\ H_2SO_4} = 38,7 +100 = 138,7(gam)\)
\(n_{oleum} = \dfrac{38,7}{258} = 0,15(mol)\\ \Rightarrow m_{H_2SO_4\ trong\ X} = 0,15.98 + 100.30\% = 44,7(gam)\\ \Rightarrow C\%_{H_2SO_4} = \dfrac{44,7}{138,7}.100\% = 32,23\%\)
Bạn xem thử xem