Đốt cháy 1.2g cacbon trong không khí thu được khí cacbondioxit a) những chất tham gia và tạo thành trong phản ứng đâu là đơn chất đâu là hợp chất vì sao b) tính khối lượng CO² thu được sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(a,\text {Bảo toàn KL: }m_{C}+m_{O_2}=m_{CO_2}\\ \Rightarrow m_{CO_2}=m_{C}+m_{O_2}=16+6=22(g)\\ b,m_{C}=m_{CO_2}-m_{O_2}=44-32=12(g)\)

Câu 13:
a) PTHH: \(S+O_2\underrightarrow{t^o}SO_2\)
Chất tham gia: \(S;O_2\)
Chất sp: \(SO_2\)
Đơn chất: \(S;O_2\)
Hợp chất: \(SO_2\)
Vì đơn chất là những chất được tạo từ 1 nguyên tố. Còn hợp chất là chất được tạo từ 2 nguyên tố trở lên.
b) \(n_S=\dfrac{4,8}{32}=0,15\left(mol\right)\)
Từ PTHH ở trên ta có:
1 mol S thì đốt cháy hết 1 mol khí oxi
=> 0,15 mol S thì đốt cháy hết 0,15 mol khí oxi
=> Thể tích của 0,15 khí oxi là:
\(V_{O_2}=0,15.22,4=3,36\left(l\right)\)

a) S + O2 -> SO2
Chất tham gia phản ứng là S và O2
Chất tạo thành phản ứng là SO2
b) \(n_S=\dfrac{4,8}{32}=0,15\left(mol\right)\)
Thể tích khí oxi (đktc) cần dùng để đốt cháy hoàn toàn 4,8 g lưu huỳnh
\(V_{O_2}=0,15.22,4=3,36\left(l\right)\)
c) dSO2/kk= \(\dfrac{M_{SO_2}}{M_{kk}}=\dfrac{32+16.2}{29}=\dfrac{64}{29}=2.2>1\)
=> Khí sunfurơ nặng hơn không khí 2,2 lần

4Al + 3O2 --to--> 2Al2O3
\(n_{Al_2O_3}=\dfrac{10,2}{102}=0,1\left(mol\right)\)
PTHH: 4Al + 3O2 --to--> 2Al2O3
___________0,15<------0,1
=> mO2 = 0,15.32 = 4,8(g)
Bảo toàn KL: \(m_{Al}+m_{O_2}=m_{Al_2O_3}\)
\(\Rightarrow m_{O_2}=10,2-9=1,2(g)\)

a, \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
b, Gọi: mO2 = x (g) ⇒ mAl = 1,5x (g)
Theo ĐLBT KL, có: mAl + mO2 = mAl2O3
⇒ 1,5x + x = 10
⇒ x = 4 (g) = mO2
mAl = 1,5.4 = 6 (g)
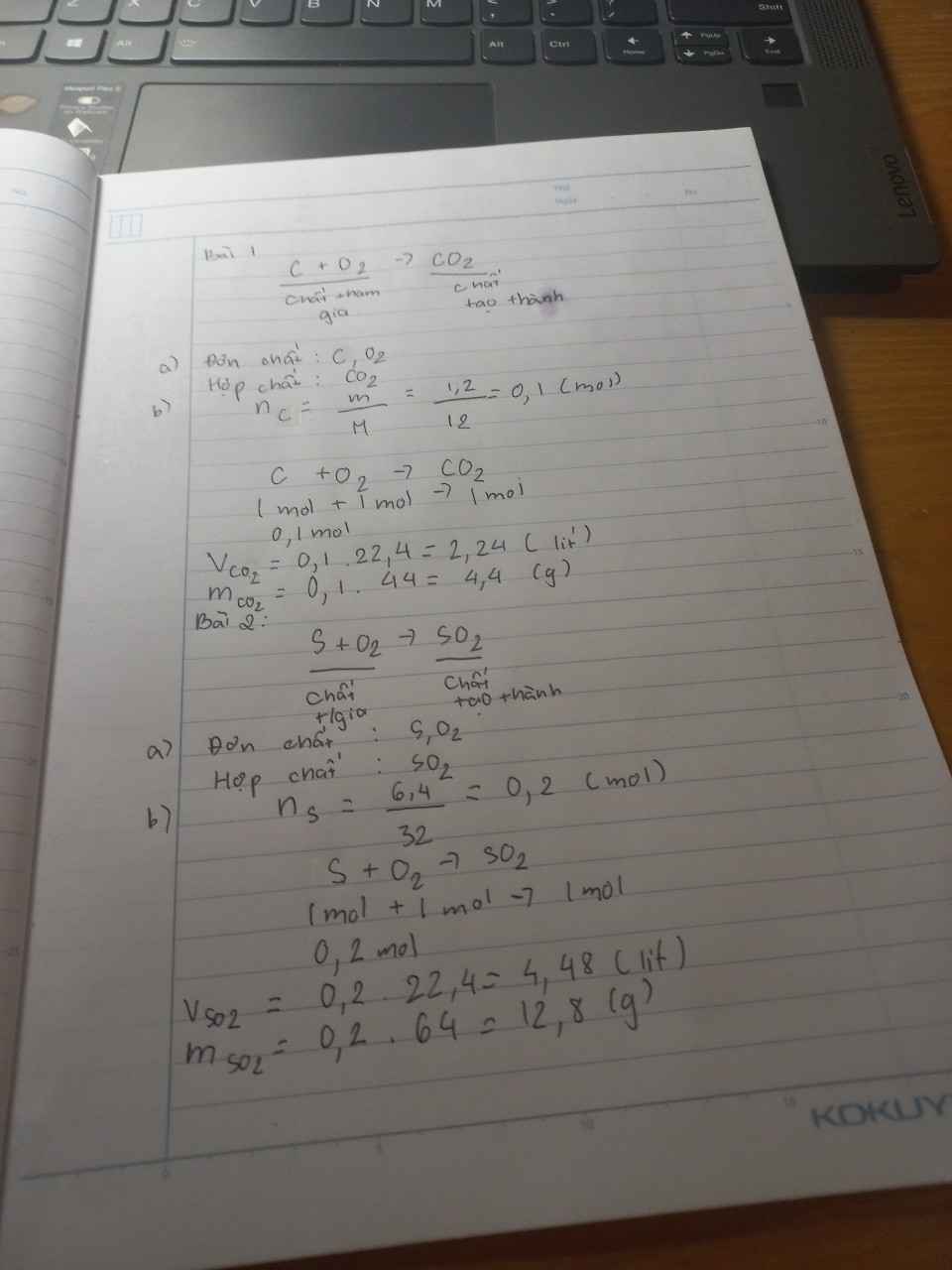


\(n_C=\dfrac{1.2}{12}=0.1\left(mol\right)\)
\(a.\)
\(C+O_2\underrightarrow{^{^{t^0}}}CO_2\)
\(0.1..............0.1\)
Đơn chất là chất cấu tạo từ 1 nguyên tố hóa học => C , O2
Hợp chất là chất cấu tạo từ 2 nguyên tố hóa học trở lên => CO2
\(m_{CO_2}=0.1\cdot44=4.4\left(g\right)\)
Bạn giải thích rõ hơn đc k ạ