Dẫn 4,48 lít khí CO2 (đktc) vào 300ml dung dịch Ca(OH)2 1M, tính khối lượng kết tủa thu được?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án A
nCO2= 6,72/22,4= 0,3 mol;
nCa(OH)2= 0,4.1= 0,4 mol
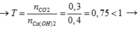
Sau phản ứng thu được muối trung hòa CaCO3
CO2 + Ca(OH)2 → CaCO3 + H2O
Ta có: 0,3 < 0,4 nên CO2 phản ứng hết, Ca(OH)2 còn dư
Ta có: nCaCO3= nCO2= 0,3 mol → mCaCO3= 0,3.100= 30,0 gam

Đáp án D
n C O 2 = 0,2 mol; n C a ( O H ) 2 = 0,1 mol; nNaOH = 0,1 mol; n O H - = 0,3 mol
T = n O H - n C O 2 = 0 , 3 0 , 2 = 1 , 5 → Tạo 2 loại muối : HCO3- và CO32-
CO2 + OH- → HCO3-
x x x mol
CO2 + 2OH- → CO32- + H2O
y 2y y mol
Có x+ y = 0,2; x+ 2y = 0,3 suy ra x = 0,1; y = 0,1
Ca2+ + CO32- → CaCO3↓
0,1 0,1 mol 0,1 mol
m C a C O 3 = 0,1. 100 = 10 gam

![]()
Do khi tăng lượng khí mà kết tủa giảm từ 7m xuống 5m nên ở lần 1 đã tạo ra 2 muối

Đáp án C

\(a/n_{CO_2}=\dfrac{4,48}{22,4}=0,2mol\\ CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\\ n_{CO_2}=n_{CaCO_3}=0,2mol\\ m_{CaCO_3}=0,2.100=20g\\ b/BTNT\left(O\right):2n_{CO_2}=n_{H_2O}\\ \Rightarrow n_{H_2O}=0,2.2=0,4mol\\ BTNT\left(H\right):2n_{H_2O}=n_{HCl}\\ n_{HCl}=0,4.2=0,8mol\\ V_{HCl}=\dfrac{0,8}{0,4}=2l\)

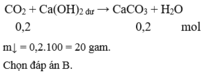
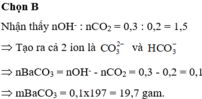

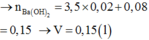
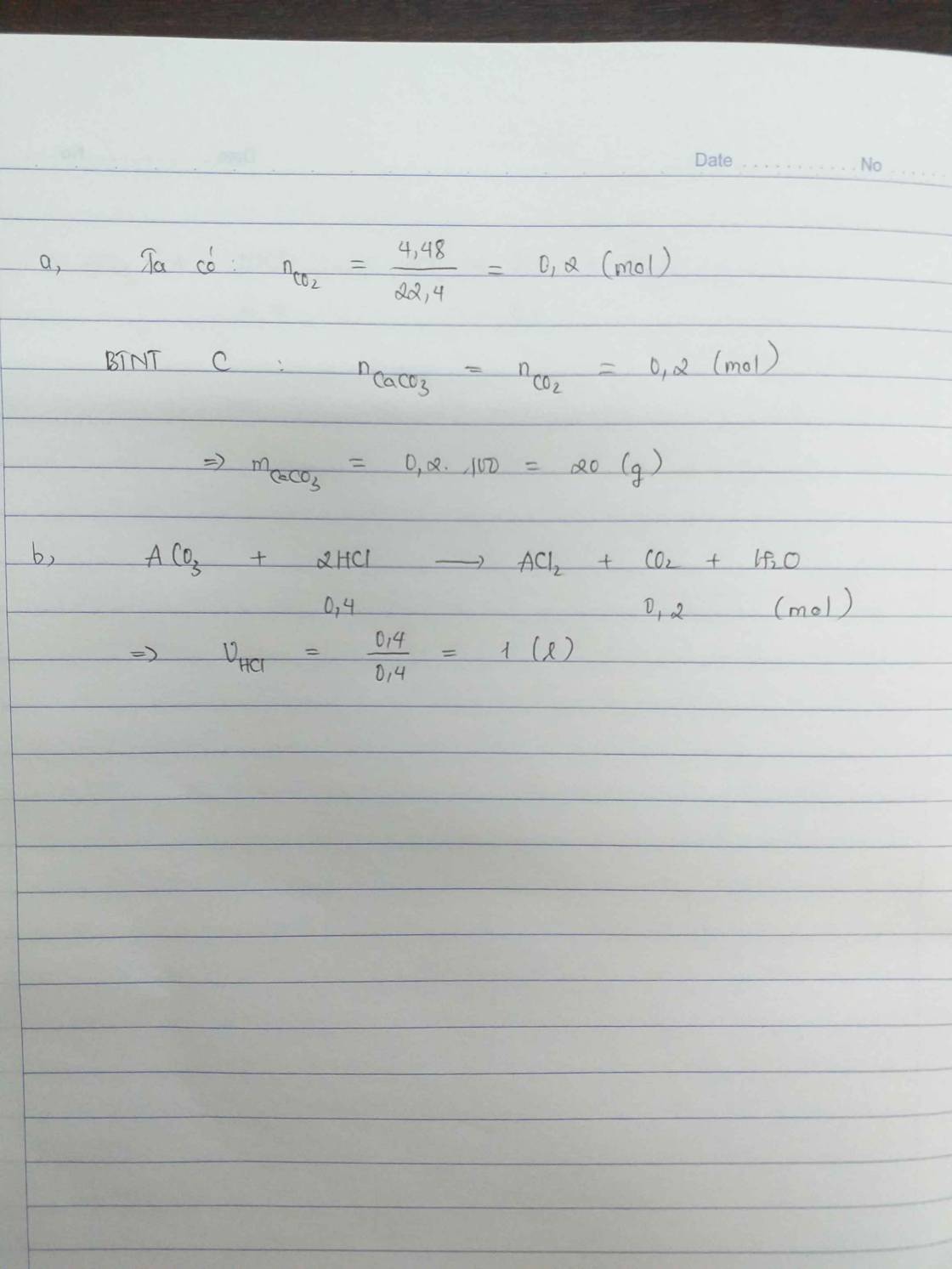
\(n_{CO_2}=\dfrac{4.48}{22.4}=0.2\left(mol\right)\)
\(n_{Ca\left(OH\right)_2}=0.3\cdot1=0.3\left(mol\right)\)
\(T=\dfrac{0.2}{0.3}=0.67\rightarrow CaCO_3,Ca\left(OH\right)_2dư\)
\(n_{CaCO_3}=n_{CO_2}=0.2\left(mol\right)\)
\(m=0.2\cdot100=20\left(g\right)\)