Cầu 30: Hòa tan bột nhóm vào dung dịch axit clohidric, thu được 5,34 gam muối khan, hiệu suất phản ứng là 90%. Khôi lượng nhôm cần dùng là ? Giúp em với ạ em đang cần gấp :
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


PTHH: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
Ta có: \(n_{HCl}=0,18\cdot1=0,18\left(mol\right)\)
\(\Rightarrow n_{H_2\left(LT\right)}=0,09\left(mol\right)\)
\(\Rightarrow H\%=\dfrac{\dfrac{1,512}{22,4}}{0,09}\cdot100\%=75\%\)
PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Ta có: \(n_{HCl}=0,18.1=0,18\left(mol\right)\)
Theo PT: \(n_{H_2\left(LT\right)}=\dfrac{1}{2}n_{HCl}=0,09\left(mol\right)\)
\(\Rightarrow V_{H_2\left(LT\right)}=0,09.22,4=2,016\left(l\right)\)
Mà: VH2 (TT) = 1,512 (l)
\(\Rightarrow H\%=\dfrac{1,512}{2,016}.100\%=75\%\)
Bạn tham khảo nhé!

\(Fe+2HCl->FeCl_2+H_2\)
Gọi số mol Fe = x (mol) => Theo phương trình suy ra số mol \(FeCl_2=x\)(mol)
Theo bài ra, khối lượng muối FeCl2 tăng 7.1 gam so với khối lượng Fe
=> 127x - 56x = 7.1
=> x = 0.1 (mol)
Theo phương trình => \(n_{HCl}=2x=0.2mol\)
\(=>V_{HCl}=\frac{0.2}{2}=0.1l=100ml\)=> Đáp án B
Chúc bạn học tốt
Phương trình hóa học phản ứng
Fe + 2HCl ---> FeCl2 + H2
Hệ số các chất 1 : 2 : 1 : 1 (1)
tham gia phản ứng
=> nFe = nFeCl2
mà: mFeCl2 - mFe = 7.1
=> nFeCl2.MFeCl2 - nFe.MFeCl2 = 7.1
=> nFeCl2.127 - nFe.56 = 7.1
=> nFe.127 - nFe.56 = 71
=> nFe = 0,1 (mol) (2)
Lại có : Cmol = \(\frac{n_{H_2SO_4}}{V_{H_2SO_4}}=2\Rightarrow n_{H_2SO_4}=2.V_{H_2SO_4}\)
Từ (1) và (2) => \(n_{H_2SO_4}=0,2\left(\text{mol}\right)\)
=> \(V_{H_2SO_4}=0,1\left(l\right)\)
=> Chọn A

a) n Fe = 28/56 = 0,5(mol)
$Fe + 2HCl \to FeCl_2 + H_2$
Theo PTHH :
n HCl = 2n Fe = 1(mol)
=> m dd HCl = 1.36,5/10% = 365(gam)
b)
n FeCl2 = n H2 = n Fe = 0,5(mol)
Suy ra :
V H2 = 0,5.22,4 = 11,2(lít)
m FeCl2 = 0,5.127 = 63,5(gam)
c)
Sau phản ứng:
mdd = m Fe + mdd HCl - m H2 = 28 + 365 - 0,5.2 = 392(gam)
=> C% FeCl2 = 63,5/392 .100% = 16,2%

Dung` DL BTKL: moxit + mH2SO4 = mmuoi' + mH2O
voi' nH2O = nH2SO4 = 0.5*0.1 = 0.05
--> mmuoi' = 2.81 + 0.05*98 - 0.05*18 = 6.81g
Cach' #: (Fe2O3, MgO, ZnO) ----> (Fe2(SO4)3; MgSO4, ZnSO4)
--> nO = nSO4(2-) = nH2SO4 = 0.05
--> m(Fe, Mg, Zn) = 2.81 - mO = 2.81 - 0.05*16 = 2.01g
mmuoi' = mKL + mSO4(2-) = 2.01 + 0.05*96 = 6.81g
bảo toàn khối lượng
Ta có nH2SO4=0,05 mol =>n H+=0,1 mol
2H+ + O2- ---> H2O
==>2,81+98.0,05=m+0.05.18 ==> m=6,81(gam)

\(n_{H_2\left(dktc\right)}=\dfrac{V}{22,4}=\dfrac{2,464}{22,4}=0,11\left(mol\right)\)
Đặt \(\left\{{}\begin{matrix}n_{Ba}=a\left(mol\right)\\n_K=b\left(mol\right)\end{matrix}\right.\left(a,b>0\right)\)
\(PTHH:Ba+2H_2O->Ba\left(OH\right)_2+H_2\left(1\right)\)
tỉ lệ 1 ; 2 : 1 : 1
n(mol) a--------->2a----------->a---------->a
\(PTHH:2K+2H_2O->2KOH+H_2\left(2\right)\)
tỉ lệ 2 : 2 : 2 ; 1
n(mol) b---------->b---------->b------------>1/2b
Ta có Hệ phương trình sau
\(\left\{{}\begin{matrix}137a+39b=11,53\\a+\dfrac{1}{2}b=0,11\end{matrix}\right.\\ < =>\left\{{}\begin{matrix}a=0,05\\b=0,12\end{matrix}\right.\\ < =>\left\{{}\begin{matrix}n_{Ba}=0,05\left(mol\right)\\n_K=0,12\left(mol\right)\end{matrix}\right.\)
Theo Phương trình (1) ta có: \(n_{Ba\left(OH\right)_2}=a=0,05\left(mol\right)\\ =>m_{Ba\left(OH\right)_2}=n\cdot M=0,05\cdot171=8,55\left(g\right)\)
Theo phương trình (2) ta có
\(n_{KOH}=b=0,12\left(mol\right)\\ m_{KOH}=n\cdot M=0,12\cdot56=6,72\left(g\right)\\ =>m_{ct}=8,55+6,72=15,27\left(g\right)\)

a)
2Al + 6HCl → 2AlCl3 + 3H2
b) nAl = 5,4 : 27 = 0,2 mol
Theo tỉ lệ phản ứng => nH2 = 0,3 mol <=> VH2 = 0,3.22,4 = 6,72 lít.
c) nAlCl3 = nAl = 0,2 mol
=> mAlCl3 = 0,2. 133,5 = 26,7 gam.
d) nHCl cần dùng = 3nAl = 0,6 mol
=> mHCl = 0,6.36,5 = 21,9 gam
<=> mdd HCl cần dùng = \(\dfrac{21,9}{3,65\%}\) = 600 gam

Khối lượng mỗi phần là 24,06 gam, gồm Al (a), Al2O3 (b) và Cr2O3 (c)
—> 27a + 102b + 152c = 24,06 (1)
nNaOH = a + 2b = 0,34 (2)
2Al + Cr2O3 —> Al2O3 + 2Cr
2x………x………x… ….2x
m rắn = 152(c – x) + 52.2x = 7,68 (3)
nO = 3b + 3c
—> nH2O = 3b + 3c
Bảo toàn H
—> nHCl = 6b + 6c + 0,11.2
—> m muối = 27(a + 2b) + 52.2c + 35,5(6b + 6c + 0,11.2) = 61,57 (4)
(1)(2)(3)(4) —> a = 0,1; b = 0,12; c = 0,06; x = 0,03
—> H = 2x/a = 60%
Đáp án A

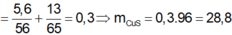
\(n_{AlCl_.}=\dfrac{5.34}{133.5}=0.04\left(mol\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(0.04......................0.04\)
\(m_{Al}=\dfrac{0.04\cdot27}{90\%}=1.2\left(g\right)\)
\(n_{AlCl_3}=\dfrac{5,34}{133,5}=0,04(mol)\\ PTHH:2Al+6HCl\to 2AlCl_3+3H_2\\ \Rightarrow n_{Al(phản ứng)}=0,04(mol)\\ \Rightarrow n_{Al(cần dùng)}=\dfrac{0,04.27}{90\%}=1,2(g)\)