Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
n C 3 H 8 ban đầu = 0 , 2 . 90 % - 0 , 18 ( mol ) = > n C 3 H 8 dư = 0 , 02
Áp dụng định luật bảo toàn khối lượng ta có:
m A = m C 3 H 8 ban đầu
=8,8 gam
![]()
![]()
Vậy ![]()

\(n_{C_3H_8}=0,4\left(mol\right)\)
\(M_X=13,75.2=27,5\left(g/mol\right)\)
\(\Rightarrow n_X=\dfrac{17,6}{27,5}=0,64\left(mol\right)\)
\(\Rightarrow n_{C_3H_8\left(pư\right)}=0,64-0,4=0,24\left(mol\right)\)
\(\Rightarrow H=\dfrac{0,24}{0,4}.100\%=60\%\)
Đề bài có thiếu đoạn nào từ X ra Y không bạn nhỉ?

Ta thấy thể tích hidrocacbon sau khi tham gia phản ứng cộng H 2 không thay đổi, chỉ có thể tích giảm đi là H 2 vào Hidrocacbon.
Suy ra: VX = 6,72 lit
⇒ Chọn A.


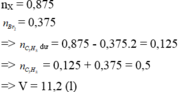
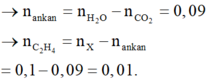
Về bản chất, đốt cháy X giống đốt cháy C3H8
\(n_{C_3H_8} = \dfrac{8,8}{44} = 0,2(mol)\\ n_{CO_2} = 3n_{C_3H_8} = 0,2.3 = 0,6(mol)\Rightarrow m_{CO_2} = 0,6.44 = 26,4(gam)\\ n_{H_2O} = 4n_{C_3H_8} = 0,2.4 = 0,8(mol)\Rightarrow m_{H_2O} =0,8.18 = 14,4(gam)\)