Hoà tan hoàn toàn 8,9 gam hỗn hợp Zn, Mg bằng dung dịch H2SO4đặcthu được 1,12 lít SO2(ởđktc), 1,6 gam S (là những sản phẩm khửduy nhất) và dung dịch X. Khối lượng muối khan trong dung dịch X làA. 28,1 g.B. 18,1 g.C. 30,4 g. D. 24,8 g.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Từ n SO2 = 1,12/22,4 = 0,05 mol và n S = 1,6/32 = 0,05 mol
--> m muối = 8,5 + 96(0,05 + 0,05 x 3) = 27,7 gam.

Đáp án A
Số mol các chất là:
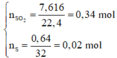
Sơ đồ phản ứng:
Al Zn ⏟ 11 , 9 g a m + H 2 S O 4 ( đ ặ c ) → Al 2 ( SO 4 ) 3 ZnSO 4 ⏟ M u ố i + S O 2 ⏟ 0 , 34 mol S ⏟ 0 , 02 m o l + H 2 o
Áp dụng công thức của bài toán kim loại tác dụng với H2SO4 đặc ta có:
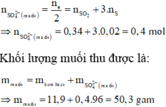

Đáp án D.
nSO2 = 0,55 => ne = 0,55.2 = 1,1 (mol)
mmuối = mKL + Mgốc axit. ne/2
= 14,6 + 96. 1,1/2 = 67,4 g

Đáp án D
Ta có mMuối = mKim loại + mSO42–.
Mà nSO42– = nH2 = 0,05 mol.
⇒ mMuối = 2,43 + 0,05×96 = 7,23 gam

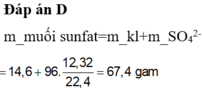
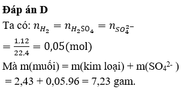
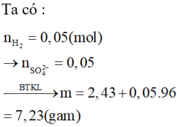
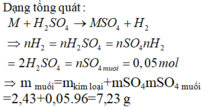
\(n_{SO_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\)
\(n_S=\dfrac{1.6}{32}=0.05\left(mol\right)\)
\(m_X=m_{hh}+96\cdot\left(n_{SO_2}+3n_S\right)=8.9+96\cdot\left(0.05+0.05\cdot3\right)=28.1\left(g\right)\)