câu 32:Nhỏ từ từ dung dịch chứa H2SO4loãng vào một lượng bột sắt, sau một thời gian, bột sắt tan hoàn toàn và người ta thu được , 7 mol H2(đktc). Khối lượng bột sắt đã dùng là:A. 4,3 gB. 4,0 gC. 4,1gD. 4,2 g
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) Fe + 2HCl --> FeCl2 + H2
b) \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,15<--------------------0,15
=> mFe =0,15.56 = 8,4 (g)

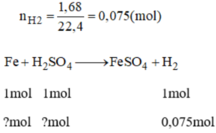
Theo phương trình phản ứng ta có:
n F e = n H 2 = 0,075 mol
n H 2 S O 4 = 0,075 mol (mà H 2 S O 4 đề cho là 0,2 mol nên H 2 S O 4 dư)
![]()

a, Ta có pt pư
\(Fe+H_2SO_4-->FeSO_4+H_2\)
Ta có
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{19,6}{98}=0,2\left(mol\right)\)
=> \(H_2SO_4\) dư
\(m_{H_2SO_4}=0,15\cdot98=14,7\left(g\right)\)
\(\Rightarrow m_{dư\left(H_2SO_4\right)}=19,6-14,7=4,9\left(g\right)\)
b,
Ta có
\(m_{Fe}=0,15\cdot56=8,4\left(g\right)\)

a, PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
b, Ta có: \(n_{H_2}=\dfrac{1,68}{22,4}=0,075\left(mol\right)\)
Theo PT: \(n_{Fe}=n_{H_2}=0,075\left(mol\right)\Rightarrow m_{Fe}=0,075.56=4,2\left(g\right)\)
c, \(n_{H_2SO_4\left(pư\right)}=n_{H_2}=0,075\left(mol\right)\Rightarrow n_{H_2SO_4\left(dư\right)}=0,2-0,075=0,125\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4\left(dư\right)}=0,125.98=12,25\left(g\right)\)

Gọi \(n_{Fe}=x\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(n_{FeCl_2}=n_{Fe}=x\left(mol\right)\)
Vì khối lượng muối FeCl2 tăng 7,1g so với khối lượng bột Fe
\(\Rightarrow127x-56x=7,1\\ \Rightarrow x=0,1\)
\(n_{H_2}=n_{Fe}=0,1\left(mol\right)\\ V_{H_2\left(ĐKTC\right)}=0,1.22,4=2,24\left(l\right)\)
Chọn D

\(n_{H2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
a) \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
0,15 0,15 0,15
b) \(n_{Fe}=\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
⇒ \(m_{Fe}=01,5.56=8,4\left(g\right)\)
c) \(n_{FeCl2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
⇒ \(m_{FeCl2}=0,2.127=25,4\left(g\right)\)
Chúc bạn học tốt
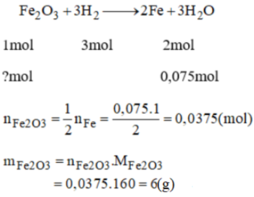

\(n_{H_2}=\dfrac{7}{2}=3.5\left(mol\right)\)
\(n_{Fe}=n_{H_2}=3.5\cdot56=196\left(g\right)\)
Em xem lại đáp án nhé !