Cho 26g kim loại M hoá trị 2 tác dụng với 200g dung dịch H2so4 tạo thành 64.4g muối khan . Xác định kim loại M và tính C% h2so4
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Xét 1 mol kim loại ứng với R (gam) tham gia phản ứng.
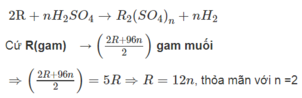
Vậy R=24 (Mg)

\(2A+3H_2SO_4\rightarrow A_2\left(SO_4\right)_3+3H_2\\ n_A=\dfrac{34,2-5,4}{96.3}.2=0,2\left(mol\right)\\ \Rightarrow M_A=\dfrac{5,4}{0,2}=27\left(\dfrac{g}{mol}\right)\\ \Rightarrow A\left(III\right):Nhôm\left(Al=27\right)\)

các bạn cố gắng giúp mình nha mình trân thành cảm ơn nhiều

Tính được : \(n_{H2}=0,1\left(mol\right)\)
PTHH :
\(R+H_2SO_4\rightarrow RSO_4+H_2\)
\(1..1...........1........1\)
\(0,1......0,1..........0,1.........0,1\)
\(M_R=\frac{M_R}{M_R}=\frac{2,5}{0,1}=25\) ( g/mol )
Vậy \(R=25\)

\(Đặt.oxit:A_2O_3\\ A_2O_3+3H_2SO_4\rightarrow A_2\left(SO_4\right)_3+3H_2O\\ n_{Al_2O_3}=\dfrac{34,2-10,2}{96.3-16.3}=0,1\left(mol\right)\\ M_{A_2O_3}=\dfrac{10,2}{0,1}=102\left(\dfrac{g}{mol}\right)=2M_A+48\\ \Rightarrow M_A=27\left(\dfrac{g}{mol}\right)\\ a,\Rightarrow A.là.nhôm\left(Al=27\right)\\ b,n_{H_2SO_4}=3.0,1=0,3\left(mol\right)\\ C\%_{ddH_2SO_4}=\dfrac{0,3.98}{100}.100=29,4\%\\ c,n_{Al_2\left(SO_4\right)_3}=n_{Al_2O_3}=0,1\left(mol\right)\\ Al_2\left(SO_4\right)_3+6NaOH\rightarrow2Al\left(OH\right)_3+3Na_2SO_4\\ n_{NaOH}=6.0,1=0,6\left(mol\right)\\ V_{ddNaOH}=\dfrac{0,6}{1,5}=0,4\left(l\right)\)

Oxit kim loại M : M2O3
$M_2O_3 + 6HCl \to 2MCl_3 + 3H_2O$
2n M2O3 = n MCl3
<=> 2.40,8/(2M + 16.3) = 106,68/(M + 35,5.3)
<=> M = 27(Al)
Vậy kim loại M là Al

Bài 12
a. Gọi kim loại cần tìm là R có \(PTK=x\)
\(n_{R_2O_3}=\dfrac{32}{2x+48}\left(mol\right);n_{H_2SO_4}=2\cdot0,3=0,6\left(mol\right)\\ PTHH:R_2O_3+3H_2SO_4\rightarrow R_2\left(SO_4\right)_3+3H_2O\\ \Rightarrow n_{R_2O_3}=\dfrac{1}{3}n_{H_2SO_4}=0,2\left(mol\right)\\ \Rightarrow\dfrac{32}{2x+48}=0,2\\ \Rightarrow2x+48=160\\ \Rightarrow x=56\left(đvC\right)\)
Vậy kim loại cần tìm là Fe (sắt) có CT oxit là \(Fe_2O_3\)
b. \(PTHH:Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
\(\Rightarrow n_{Fe_2\left(SO_4\right)_3}=n_{Fe_2O_3}=0,2\left(mol\right)\\ \Rightarrow m_{Fe_2\left(SO_4\right)_3}=0,2\cdot400=80\left(g\right)\)
Bài 13:
a. Vì Ag không phản ứng với \(H_2SO_4\) nên 7,437 lít khí là sản phẩm của Al với \(H_2SO_4\)
\(PTHH:2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ n_{H_2}=\dfrac{7,437}{24,79}=0,3\left(mol\right)\\ \Rightarrow n_{Al}=0,2\left(mol\right)\\ \Rightarrow m_{Al}=0,2\cdot27=5,4\left(g\right)\\ \Rightarrow\%m_{Al}=\dfrac{5,4}{9}\cdot100\%=60\%\\ \Rightarrow\%m_{Ag}=100\%-60\%=40\%\)
b. \(n_{H_2SO_4}=n_{H_2}=0,3\left(mol\right)\)
\(\Rightarrow m_{CT_{H_2SO_4}}=0,3\cdot98=29,4\left(g\right)\\ \Rightarrow m_{dd_{H_2SO_4}}=\dfrac{29,4\cdot100\%}{10\%}=294\left(g\right)\)

Giả sử KL có hóa trị n.
Ta có: mKL + mSO4 = m muối
⇒ mSO4 = 2,4 (g) \(\Rightarrow n_{H_2}=n_{H_2SO_4}=n_{SO_4}=\dfrac{2,4}{96}=0,025\left(mol\right)\)
BT e, có: n.nKL = 2nH2 \(\Rightarrow n_{KL}=\dfrac{0,05}{n}\left(mol\right)\)
\(\Rightarrow M_{KL}=\dfrac{1,4}{\dfrac{0,05}{n}}=28n\left(g/mol\right)\)
Với n = 2 thì M = 56 (g/mol) là thỏa mãn.
Vậy: KL cần tìm là sắt (Fe).
pthh M + h2so4 -> Mhso4 + h2
Mg (M+96)g
26 64,4
suy ra 64,4M= 26.(M+96)
64,4M= 26M + 2496
64,4M-26M=2496
38,4M=2496
M=65 M là Zn
câu b còn lại b tự làm nhé!