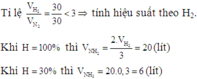3. cho 4 lit N2 tác dụng với 9 lit H2 trong điều kiện thích hợp sẽ tạo ra bao nhiêu lit NH3? ( Giả sử hiệu suất phản ứng đạt 25%)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Ta có: \(n_{N_2}=0,2\left(mol\right)\)
\(n_{H_2}=0,3\left(mol\right)\)
PT: \(N_2+3H_2⇌2NH_3\)
Xét tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,3}{1}\)
Vậy: Nếu pư hoàn toàn thì H2 hết.
⇒ Tính theo số mol H2.
Mà: H% = 25%
\(\Rightarrow n_{H_2\left(pư\right)}=0,3.25\%=0,075\left(mol\right)\)
Theo PT: \(n_{NH_3}=\dfrac{2}{3}n_{H_2}=0,05\left(mol\right)\)
\(\Rightarrow V_{NH_3}=0,05.22,4=1,12\left(l\right)\)
Bạn tham khảo nhé!

- Đáp án A
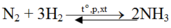
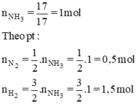
Do hiệu suất 25% nên
nN2cần dùng = 2( mol) và nH2cần dùng = 6(mol).
⇒VN2 = 2. 22,4 = 44,8 (lit) và VH2 = 22,4. 6= 134,4 (lit).

N2+3H2---->2NH3
Tie lệ
\(\frac{30}{1}>\frac{30}{3}\)--->N2 dư..tính theo H2
Theo pthh2
n NH3=2/3n H2
-->VNH3=2/3V H2=\(\frac{30.2}{3}=20\left(l\right)\)
Do H%=40%
-->V NH3=\(\frac{20.40}{100}=9\left(l\right)\)

ban đầu nN2+ nH2=500 và nN2/nH2=1/4
=>nN2=100 mol và nH2=400 mol
N2 + 3H2 ---> 2NH3
ban đầu 100 400 0
phản ứng x 3x 2x
sau phản ứng (100-x ) ( 400-3x) 2x
lại có 50=2x=> x=25 => H%=( 25/100). 100%=25%.

1) N2 + 3H2 ------> 2NH3
x -------> 3x -----------> 2x
theo tỉ lệ đề bài chon n(N2) = 1 mol và n(H2) = 3 mol
gọi x là số mol N2 tham gia pứ
ta có pt đại số theo tỉ khối là:
M(A)/MB) = 0,6 <=> (m/4)/(1 - x + 3 - 3x + 2x) = 0,6 (m: khối lượng của hỗn hợp)
=> x = 0,8
H% = 0,8/1 *100 = 80%
2) ( Bạn đã cho thiếu đề rồi. Bây giờ tôi sẽ thêm vào 10 lit H2)
N2 + 3H2 ------> 2NH3