Dung dịch X chứa a m o l B a ( O H ) 2 v à m g a m N a O H . Sục từ từ C O 2 đến dư vào dung dịch X, lượng kết tủa phụ thuộc số mol C O 2 được biểu diễn theo đồ thị dưới đây
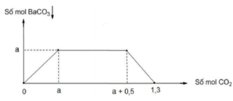
A. 0,4 và 40,0
B. 0,4 và 20,0
C. 0,5 và 24,0
D. 0,5 và 20,0
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Có 2 cách giải:
\(xy+2x+3y+5=0\)
\(\Leftrightarrow x\left(y+2\right)=-3y-5\)
\(\Leftrightarrow x=\frac{-3y-5}{y+2}\)
\(\Leftrightarrow x=\frac{-3y-6}{y+2}+\frac{1}{y+2}\)
\(\Leftrightarrow x=-3+\frac{1}{y+2}\)
Để \(x\in Z\)
Mà \(-3\in Z\)
\(\Rightarrow\frac{1}{y+2}\in Z\)
\(\Rightarrow1⋮\left(y+2\right)\)
\(\Rightarrow\orbr{\begin{cases}y+2=-1\\y+2=1\end{cases}}\)\(\Leftrightarrow\orbr{\begin{cases}y=-3\\y=-1\end{cases}}\)
*Nếu y = -3 => x = - 4.
*Nếu y = -1 => x = -2.

I
- Chất tan là chất hòa tan được trong chất khác để tạo ra dung dịch
VD: NaCl (rắn), rượu (lỏng), HCl (khí)
- Dung môi là chất hòa được chất khác để tạo thành dung dịch
- Dung dịch là hỗn hợp đồng nhất của chất tan và dung môi.
II:
- Dung dịch bão hòa tại một nhiệt độ xác định là dung dịch chứa lượng tối đa chất tan ( ko thể hòa tan thêm) tại nhiệt độ đó
- Dung dịch chưa bão hòa là dung dịch chưa chứa lượng chất tan tối đa (có thể hào tan thêm được)
III: Tăng nhiệt độ, khuấy, nghiền nhỏ chất tan
MIK NGHĨ ZẬY ^^

Bài 4
TN1: CO32- + H+ -----> HCO3-
0.2.......0.2..............0.2
HCO32-+ H+------> CO2↑+ H2O
0.6.........0.6.............0.6
=>VCO2=0.6*22.4=13.44 lít
TN2: CO32- + 2H+ -----> CO2↑+ H2O
0.2..........0.4..............0.2
HCO3- + H+ ------> CO2↑+ H2O
0.4..........0.4...............0.4
=> VCO2=0.6*22.4=13.44 lít
TN3: Giả sử HCO3 phản ứng trước
HCO3- + H+ ------> CO2↑+ H2O
0.5.........0.5...............0.5
CO32- + 2H+ -------> CO2↑+ H2O
0.15.......0.3...................0.15
=> VCO2=0.65*22.4=14.56 lít
Giả sử CO32- phản ứng trước
CO32-+ 2H+ --------> CO2↑+ H2O
0.2........0.4..................0.2
HCO3-+ H+ ---------> CO2↑+ H2O
0.4.........0.4..................0.4
=> VCO2=0.6*22.4=13.44 lít
Do đó thể tích CO2 nằm trong khoảng: 13.44<VCO2<14.56
Bài 6
nH2=0.7 mol
Ta luôn có nSO42-=nH2SO4=nH2=0.7 mol
=> x=mmuối-mgốc axit=82.9-96*0.7=15.7 g

1/ a, Theo đề bài ta có
nH2SO4=0,5 mol
\(\Rightarrow\) mH2SO4=0,2.98=19,6 g
mdd=mct+mdm=19,6 + 151=170,6 g
\(\Rightarrow\) Nồng độ % của dung dịch là
C%=\(\dfrac{mct}{mdd}.100\%=\dfrac{19,6}{170,6}.100\%\approx11,49\%\)
b, Theo đề bài ta có
VH2O=280 ml \(\Rightarrow\) mH2O=280 g
mdd = mct + mdm = 20 +280 = 300 g
\(\Rightarrow\) C%= \(\dfrac{mct}{mdd}.100\%=\dfrac{20}{300}.100\%\approx6,67\%\)
5/ * Phần tính toán
Ta có
Số mol của NaOH có trong 500ml dung dịch NaOH 1M là
nNaOH=CM.V=0,5.1=0,5 mol
\(\Rightarrow\) Khối lượng của NaOH cần dùng là
mNaOH = 0,5 .40 =20 g
\(\Rightarrow\) Khối lượng của dung dịch NaOH là
mddNaOH=\(\dfrac{mct.100\%}{C\%}=\dfrac{20.100\%}{25\%}=80g\)
Ta có công thức
m=D.V
\(\Rightarrow\) V=\(\dfrac{m}{D}=\dfrac{80}{1,2}\approx66,67ml\)

a,
nCuSO4 bđ= 0,5.0,2= 0,1 mol
nCuSO4 dư= 0,5.0,1= 0,05 mol
\(\rightarrow\) nCuSO4 pu= 0,05 mol
m tăng= mCu- mM pu
Gọi x là mCu\(\rightarrow\) x-0,4 là mM pu
\(\rightarrow\)nCu= \(\frac{x}{64}\)mol; nM pu= \(\frac{x-0,4}{M}\) mol
M+ CuSO4\(\rightarrow\)MSO4+ Cu
nCu= nCuSO4 pu\(\rightarrow\) \(\frac{x}{64}\)= 0,05 \(\Leftrightarrow\) x= 3,2
nM pu= \(\frac{3,2-0,4}{M}\)= \(\frac{2,8}{M}\)= nCuSO4 pu= 0,05
\(\Leftrightarrow\) M= 56. Vậy M là Fe
b,
nAgNO3= 0,1 mol
nCu(NO3)2= 0,1 mol
- Giả sử Fe dư, hỗn hợp A gồm Cu, Ag, Fe dư
nAg= nAgNO3; nCu= nCu(NO3)2
mAg,Cu= 0,1.108+ 0,1.64= 17,2g (loại vì lớn hơn 15,28g) \(\rightarrow\) loại luôn trường hợp Fe tác dụng vừa đủ với 2 muối
- Giả sử Fe chỉ đẩy hết Ag. Hỗn hợp spu chỉ gồm Ag
nAg= nAgNO3= 0,1 mol
\(\rightarrow\) mAg= 0,1.108= 10,8g (loại vì khác 15,28g)
- Giả sử Fe đẩy hết Ag và 1 phần Cu. Hỗn hợp spu gồm Ag, Cu
mAg= 0,1.108= 10,8g
\(\rightarrow\)mCu= 15,28-10,8= 4,48g
nAg= 0,1 mol
nCu= 0,07 mol
Fe+ 2AgNO3 \(\rightarrow\) Fe(NO3)2+ 2Ag
Fe+ Cu(NO3)2 \(\rightarrow\) Fe(NO3)2+ Cu
\(\rightarrow\)nFe= 0,1:2+ 0,07= 0,12 mol
\(\rightarrow\) mFe= m= 0,12.56= 6,72g
- Giả sử Fe chỉ đẩy một phần Ag. Hỗn hợp spu chỉ gồm Ag
nAg= \(\frac{15,28}{108}\)= 0,14 mol
Fe+ 2AgNO3\(\rightarrow\) Fe(NO3)2+ 2Ag
\(\rightarrow\) nFe= 0,07 mol
mFe= m= 0,07.56= 3,92g
Vậy m= 3,92g hoặc m= 6,72g
Đáp án B
Phân tích đồ thị: