Điện phân 1 lít dung dịch X chứa a mol CuSO4 và b mol HCl với điện cực trơ, màn ngăn xốp và dùng điện không đổi, trong thời gian t giây thu được dung dịch pH = 1. Nếu điện phân thêm t giây nữa thì thu được dung dịch có pH = 2. Dung dịch thu được không có khả năng tạo kết tủa với dung dịch AgNO3. Giả sử thể tích dung dịch giảm không đáng kể và khí sinh ra thoát ra hết khỏi dung dịch. Giá trị của a là
A. 0,005.
B. 0,045.
C. 0,015.
D. 0,095.

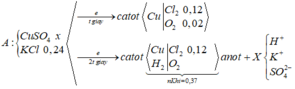



Đáp án B
► Dung dịch thu được không pứ với AgNO₃ ⇒ dung dịch thu được không còn Cl⁻
Ở đây ta cần chú ý, với H⁺ bị điện phân tại catot và anot bị điện phân H₂O
thì: 2H⁺ + 2e → H₂ || 2H₂O → 4H⁺ + O₂ + 4e ⇒ cộng lại cho khử e thì:
2H₂O → 2H₂ + O₂ ⇒ xem như điện phân H₂O ⇒ pH không đổi
Mà ta thấy sau t(s) đầu tới t(s) sau thì pH bị thay đổi
⇒ H₂O và H⁺ không bị điện phân cùng lúc ngay t(s) đầu
► Mặt khác, phần xem như điện phân H₂O không cần quan tâm vì không có gì đặc biệt
⇒ xét phần còn lại, thấy nH⁺ giảm = nH⁺ bị điện phân = 0,1 – 0,01 = 0,09 mol
nH⁺ sau khi điện phân t(s) = 0,1 mol = nHCl ban đầu ⇒ nCl⁻ = 0,1 mol
BTe: nCu = (0,1 – 0,09) = 0,005 mol