Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Thời gian điện phân t:
n k h í = 3 , 136 22 , 4 = 0,14 mol
Anot:
Cl- → Cl2 +2e
0,24 0,12 0,24 mol
H2O → H+ + O2 + 4e
0,02 0,08 mol
ne trao đổi = 0,32 mol
ne trao đổi = I t F
=> thời gian 2t, ne trao đổi = 0,64 mol
thời gian điện phân 2t nkhí = 0,37 mol
khi đó anot :
Cl- → Cl2 + 2e
0,24 0,12 0,24 mol
H2O → H+ + O2 + 4e
0,1 0,4 mol
=> n H 2 = 0,37- 0,12 – 0,1 = 0,15 mol
catot:
Cu2+ +2e → Cu
x 2x x mol
H2O + 2e → 2OH- + H2
0,15 0,3 0,3 0,15 mol
2x+0,3 = 0,64
=> x = 0,17 mol
mặt khác
nH+ =0,1 mol ⇒ [H+] = 0,1
⇒ pH = 1

Đáp án B
Các quá trình có thể xảy ra ở 2 điện cực:
+) Catot: Cu2+ + 2e → Cu
2H2O + 2e → 2OH- + H2
+) Anot: 2Cl- → Cl2 + 2e
2H2O → 4H+ + O2 + 4e
- Khi điện phân trong t giây:
nkhí Anot = 2,464: 22,4 = 0,11 mol
nCl2 = 0,5nCl- = 0,1 mol < 0,11 => Nước đã bị điện phân ở Anot
=> nO2 = nkhí anot – nCl2 = 0,11 – 0,1 = 0,01 mol
=> ne trao đổi = 2nCl2 + 4nO2 = 2.0,1 + 4.0,01 = 0,24 mol
- Khi điện phân trong 2t giây:
=> Số mol electron trao đổi sẽ gấp đôi: ne trao đổi = 2.0,24 = 0,48 mol
+) Tại Anot: nCl2 = 0,1 mol
Có: ne = 2nCl2 + 4nO2 => nO2 = ¼ (0,48 – 2.0,1) = 0,07 mol
=> nkhí Anot = nCl2 + nO2 = 0,1 + 0,07 = 0,17 mol
nkhí = 5,824: 22,4 = 0,26 mol > 0,17 => Nước bị điện phân ở Catot
=> nH2(Catot) = 0,26 – 0,17 = 0,09 mol
- Bảo toàn e: ne trao đổi = 2nCu2+ + 2nH2 = 4nO2 + 2nCl2
=> nCu2+ = ½ (4.0,07 + 2.0,1 – 2.0,09) = 0,15 mol
=> m = mCuSO4 = 160.0,15 = 24g



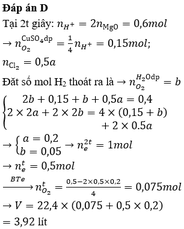


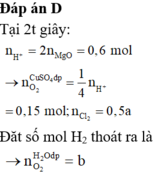


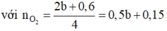
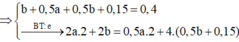
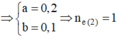
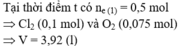
Chọn đáp án D
nKhí ở anot = 0,14 > 0,24/2 Þ Có tạo O2 với nO2 = 0,14 – 0,24/2 = 0,02
Tại t giây có ne = 0,12 x 2 + 0,02 x 4 = 0,32 Þ Tại 2t giây có ne = 0,32 x 2 = 0,64
Þ nO2 tại 2t giây = (0,64 - 0,12 x 2)/4 = 0,1 Þ nH2 = 0,37 - 0,12 - 0,1 = 0,15
Þ nCu tại 2t giây = 0,64/2 - 0,15 = 0,17 Þ x = 0,17 Þ nSO42- trong X = 0,17
BTNT.K Þ nK+ = 0,24; BTĐT trong X Þ nH+ = 0,17 x 2 - 0,24 = 0,1 Þ [H+] = 0,1M Þ pH = y = 1