Nhiệt phân hoàn toàn 36,9 gam hỗn hợp hai muối nitrat của hai kim loại hóa trị II (trong chân không). Sau khi phản ứng kết thúc thu được 0,475 mol khí và hỗn hợp rắn. Dẫn luồng kí H2 (dư) qua hỗn hợp rắn sau phản ứng thì thấy lượng H2 phản ứng là 0,25 mol và còn lại 12,1 gam chất rắn. Hai kim loại tạo thành hỗn hợp muối là:
A. Ba và Zn
B. Zn và Fe
C. Ca và Fe
D. Fe và Hg


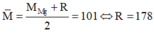
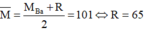
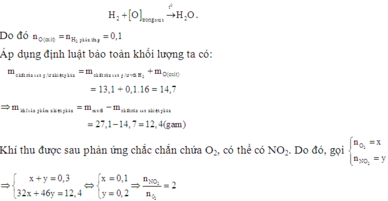

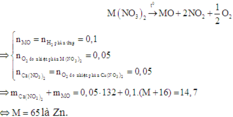


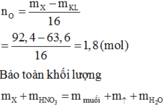

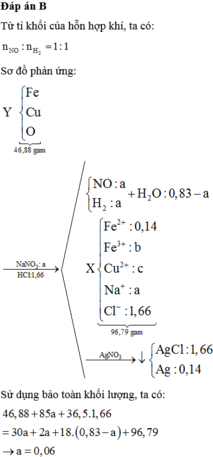

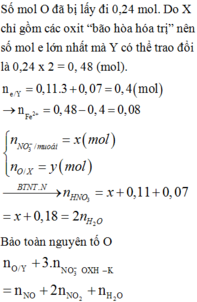
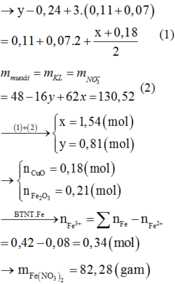
Đáp án B
Vì hỗn hợp rắn sau phản ứng có phản ứng với H2 nên trong hỗn hợp này có chứa oxit kim loại có khả năng phản ứng với H2.
Có thể coi quá trình oxit kim loại phản ứng với H2 diễn ra đơn giản như sau:
Mà hỗn hợp ban đầu là hai muối nitrat của hai kim loại hóa trị II (đề bài không đưa ra giả thiết hóa trị không đổi) nên để thu được tỉ lệ số mol giữa NO2 và O2 như trên thì hỗn hợp chứa một muối nitrat của kim loại có hóa trị II không đổi (khi nhiệt phân cho n N O 2 : n O 2 ≤ 4 ) và một muối nitrat kim loại nhiệt phân tạo thành oxit của kim loại có hóa trị của kim loại tăng từ II trong muối lên hóa trị III trong oxit (khi nhiệt phân cho n N O 2 : n O 2 = 8).Gọi công thức của hai muối trong hỗn hợp ban đầu là M(NO3)2 và R(NO3)2 trong đó kim loại M có hóa trị II không đổi.
Các trường hợp có thể xảy ra:
+) M(NO3)2 nhiệt phân tạo muối nitrit : ( n N O 2 : n O 2 = 0)
Do đó trường hợp này không thỏa mãn.
+) M(NO3)2 nhiệt phân tạo oxit kim loại tương ứng ( n N O 2 : n O 2 = 4)
Mặt khác, với kiến thức THPT thì những kim loại nằm trong trường hợp nhiệt phân muối nitrat tạo oxit kim loại với hóa trị tăng từ II lên III thì ta biết Fe hoặc Cr.
Nên
* Nếu R là Fe thì M = 121 – 56 = 65 là Zn
* Nếu R là Cr thì M = 96 – 52 = 46 (loại)
+) M(NO3)2 nhiệt phân tạo kim loại tương ứng ( n N O 2 : n O 2 = 2)
Tương tự như trường hợp 2, ta có:
* Nếu R là Fe thì M = 363– 56.5 = 83 (loại)
* Nếu R là Cr thì M = 363 – 52.5 = 103 (loại)
Vậy hai kim loại cần tìm là Zn và Fe.