Cho 250ml dung dịch Ba(OH)2 0,4M vào 250ml dung dịch H2SO4 0,3M. Nồng độ mol của chất trong dung dịch sau phản ứng
A. 0,05M B.0,15M C.0,2M D.0,025M
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(1.3NaOH+H_3PO_4\rightarrow Na_3PO_4+3H_2O\\ a=n_{H_3PO_4}=\dfrac{1}{3}n_{NaOH}=\dfrac{1}{3}\cdot0,9=0,3mol\\ \Rightarrow A\\ 2.n_{Ba\left(OH\right)_2}=0,2.0,4=0,08mol\\ n_{H_2SO_4}=0,25.0,3=0,075mol\\ Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4+2H_2O\\ \Rightarrow\dfrac{0,08}{1}>\dfrac{0,075}{1}\Rightarrow Ba\left(OH\right)_2.dư\\ n_{BaSO_4}=n_{H_2SO_4}=0,075mol\\ m_{\uparrow}=m_{BaSO_4}=0,075.233=16,725g\\ \Rightarrow?:))\\ 3.n_{KOH}=0,2.1=0,2mol\\ n_{H_2SO_4}=0,2.1=0,2mol\\ 2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O\\ \Rightarrow\dfrac{0,2}{2}< \dfrac{0,2}{1}\Rightarrow H_2SO_4.dư\\ n_{H_2SO_4.pư}=\dfrac{1}{2}n_{KOH}=\dfrac{1}{2}\cdot0,2=0,1mol\\ n_{H_2SO_4_4.dư}=0,2-0,1mol\\ H_2SO_4+Mg\rightarrow MgSO_4+H_2\\ n_{H_2}=n_{H_2SO_4.dư}=0,1mol\\ V_{H_2}=0,1.24,79=2,479l\\ \Rightarrow A\)

Em ko có tiền nên mong a , cj tham khảo(đây là 500 g dung dịch nên mong a, cj sửa 1 chút ạ)
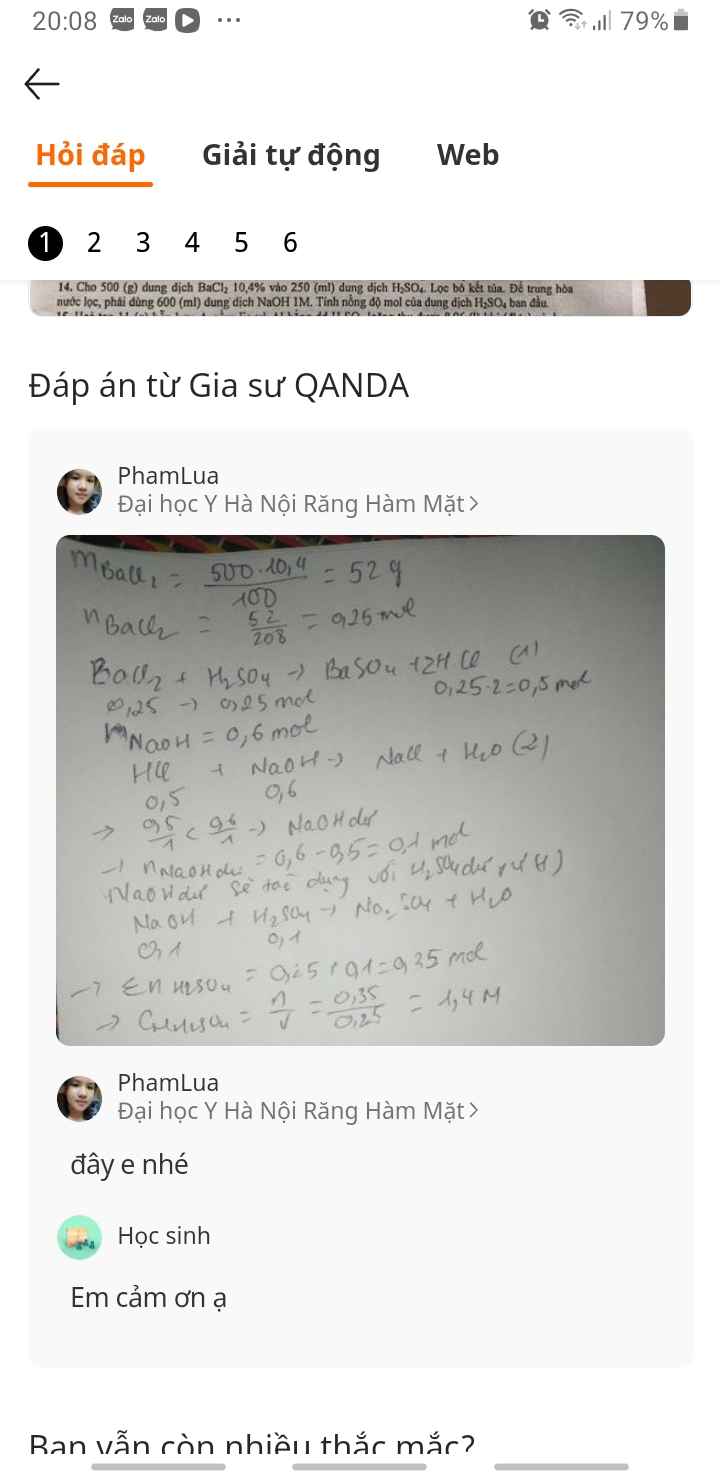

2)
nKOH = 0.15*2=0.3 mol
nHCl = 0.25*3=0.75 mol
KOH + HCl --> KCl + H2O
Bđ: 0.3____0.45
Pư : 0.3____0.3____0.3
Kt: 0______0.15___0.3
DD sau phản ứng : 0.15 mol HCl dư , 0.3 mol KCl
CM H+= 0.15/0.25=0.6M
CM Cl- = 0.15/0.25=0.6 M
CM K+= 0.3/(0.15+0.25)=0.75M
CM Cl-= 0.3/(0.15+0.25)= 0.75M

Chọn C

K ế t t ủ a l à B a S O 4 → n ↓ = n H 2 S O 4 = 0 , 075 m o l m ↓ = 0 , 075 . 233 = 17 , 475 g a m .

Đáp án A
Gọi thể tích dung dịch A là V1 lít. Có nH+ = ( 0,2+0,3+0,1.2+0,3).V1 = V1 mol
Gọi thể tích dung dịch B là V2 lít. Có nOH- = ( 0,3+ 0,4+ 0,15.2).V2 = V2 mol
H+ + OH- → H2O
V1 V2
Dung dịch thu được có pH = 13 nên OH- dư
nOHdư = V2- V1 mol
[OH-]dư = (V2-V1)/(V2+ V1) = 10-1 suy ra V1: V2 = 11:9

Chọn B.
Nồng độ H+ ban đầu là: (0,2 + 0,3 + 0,1.2 + 0,3) = 1M.
Nồng độ OH- ban đầu là: (0,3 + 0,4 + 0,15.2) = 1M.
Dung dịch sau phản ứng có pH = 13, suy ra OH- dư, pOH = 1.
Nồng độ OH- dư là: 10-1 = 0,1M.
Áp dụng sơ đồ đường chéo cho trường hợp OH- dư, ta được:
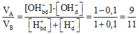

Đáp án B.
Nồng độ H+ ban đầu là: (0,2 + 0,3 + 0,1.2 + 0,3) = 1M.
Nồng độ OH- ban đầu là: (0,3 + 0,4 + 0,15.2) = 1M.
Dung dịch sau phản ứng có pH = 13, suy ra OH- dư, pOH = 1.
Nồng độ OH- dư là: 10-1 = 0,1M.
Áp dụng sơ đồ đường chéo cho trường hợp OH- dư, ta được:
VA/VB = (1-0,1)/(1+0,1) = 9/11

PTHH: H2SO4+2NaOH→Na2SO4+2H2O
nH2SO4=0,25×1=0,25 mol.
Theo pt: nNaOH=2nH2SO4=0,5 mol.
Theo pt: nNa2SO4=nH2SO4=0,25 mol.
Vdd spư=250+250=500 ml=0,5 lít.
⇒CM NaOH=0,5/0,25=2 M.
CM Na2SO4=0,25/0,5=0,5 M.