hỗn hợp khí A gồm so2, co2, co. trộn a với o2 dư đốt nóng có xúc tác v2o5 thu được hơn hợp khí x. hòa tan x bằng h2so4 98% được khí y và chất lỏng z
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Ta có số mol e kim loại nhường là (19,7 - m)/8 + 0,8
Ta có số mol e nhận tạo khi SO2 là (19,7 -m)/8 + 0,8 => Số mol SO2 là (29,7 - m)/16 + 0,4
Trong phản ӭng với H2SO4 đặc, ta có số mol H2SO4 = số mol H2O = 2 số mol SO2
Áp dụng bảo toàn khối lượng => m = 26,5
=> Đap an C

Hỗn hợp A ban đầu có SO2 : a mol, N2: 4a mol và O2: a mol.
Phản ứng:
2SO2 + O2< --> 2SO3 (XT: V2O5, t0) (1)
Gọi số mol SO2 phản ứng là x.
Theo (1): Số mol giảm = số mol O2 phản ứng = 0,5x mol
=> nB = 6a – 0,5x mol
Theo định luật bảo toàn khối lượng: mA = mB = m
\(d_{A/B}=\dfrac{m}{6a}:\dfrac{m}{6a-0,5x}=\dfrac{6a-0,5x}{6a}=0,93\)
\(\Rightarrow\dfrac{x}{a}=0,84\)
\(VậyH\%=84\%\)

ttheo đề ta có:
\(nMg=0,6\left(mol\right);nSO_2=0,6\left(mol\right)\)
pthh:
\(SO_2+2Mg\rightarrow S+2MgO\)
Chất rắn D gồm MgO và S
\(MgO+2HNO_3\rightarrow Mg\left(NO_3\right)_2+H_2O\)
\(S+6HNO_3\rightarrow H_2SO_4+6NO_2+2H_2O\)
\(nNO_2=n_S.6=0,6.6=3,6\left(mol\right)\Rightarrow VNO_2=3,6.22,4=80,64\left(lít\right)\)
Khi cho \(Ba\left(OH\right)_2\) vào Y thu được kết tủa gồm \(Mg\left(OH\right)_2vàBaSO_4\)
\(m\downarrow=0,6.58+0,6.233=174,6\left(g\right)\)
=> Hiệu suất tổng hợp của SO3 là 62,5%

Có \(A\left\{{}\begin{matrix}n_{SO_2}+n_{O_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\\\dfrac{64.n_{SO_2}+32.n_{O_2}}{n_{SO_2}+n_{O_2}}=25,6.2=51,2\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}n_{SO_2}=0,3\left(mol\right)\\n_{O_2}=0,2\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}\%V_{SO_2}=\dfrac{0,3}{0,5}.100\%=60\%\\\%V_{O_2}=\dfrac{0,2}{0,5}.100\%=40\%\end{matrix}\right.\)
Gọi số mol SO2 phản ứng là x (mol)
PTHH: 2SO2 + O2 --> 2SO3
Trc pư: 0,3 0,2 0
Pư: x------>0,5x------>x
Sau pư: (0,3-x) (0,2-0,5x) x
=> \(M_B=\dfrac{m_B}{n_B}=\dfrac{m_A}{n_B}=\dfrac{25,6}{\left(0,3-x\right)+\left(0,2-0,5x\right)+x}=32.2=64\)
=> x = 0,2
=> \(B\left\{{}\begin{matrix}SO_2:0,1\left(mol\right)\\O_2:0,1\left(mol\right)\\SO_3:0,2\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}\%V_{SO_2}=\dfrac{0,1}{0,1+0,1+0,2}.100\%=25\%\\\%V_{O_2}=\dfrac{0,1}{0,1+0,1+0,2}.100\%=25\%\\\%V_{SO_3}=\dfrac{0,2}{0,1+0,1+0,2}.100\%=50\%\end{matrix}\right.\)
- Xét hỗn hợp khí A:
Gọi x,y lần lượt là số mol của SO2 và O2 trong hỗn hợp. (x,y>0) (mol)
\(x+y=\dfrac{11,2}{22,4}=0,5\left(1\right)\\ Mà:M_A=25,6.M_{H_2}=25,6.2=51,2\left(\dfrac{g}{mol}\right)\\ \Leftrightarrow\dfrac{64x+32y}{0,5}=51,2\\ \Leftrightarrow64x+32y=25,6\left(2\right)\\ \left(1\right),\left(2\right)\Rightarrow\left\{{}\begin{matrix}x+y=0,5\\64x+32y=25,6\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,3\\y=0,2\end{matrix}\right.\\ \Rightarrow\%V_{\dfrac{SO_2}{A}}=\dfrac{0,3}{0,5}.100=60\%\Rightarrow\%V_{\dfrac{O_2}{A}}=100\%-60\%=40\%\)
- Xét hỗn hợp khí B:
Gọi a là số mol SO3 được tạo thành trong hhB (mol) (a,b>0)
\(PTHH:2SO_2+O_2\rightarrow\left(xt,t^o\right)2SO_3\\ \Rightarrow n_{SO_2\left(hhB\right)}=0,3-a\left(mol\right)\\ n_{O_2\left(hhB\right)}=0,2-0,5a\left(mol\right)\\ M_{hhB}=32.M_{H_2}=32.2=64\left(\dfrac{g}{mol}\right)\\ \Leftrightarrow\dfrac{80a+\left(0,2-0,5a\right).32+\left(0,3-a\right).64}{a+\left(0,2-0,5a\right)+\left(0,3-a\right)}=64\\ \Leftrightarrow a=0,2\\ \Rightarrow hhB\left\{{}\begin{matrix}SO_3:0,2\left(mol\right)\\SO_2:0,1\left(mol\right)\\O_2:0,1\left(mol\right)\end{matrix}\right.\\ \Rightarrow\%V_{\dfrac{SO_3}{hhB}}=\dfrac{0,2}{0,2+0,1+0,1}.100=50\%\\ \%V_{\dfrac{SO_2}{hhB}}=\%V_{\dfrac{O_2}{hhB}}=\dfrac{0,1}{0,2+0,1+0,1}.100=25\%\)
Em xem có gì không hiểu thì hỏi lại nhá!

Mol SO2=2,688/22,4=0,12 mol
M \rightarrow M+2 +2e
0,12 mol<= 0,24 mol
S+6 +2e \rightarrow S+4
0,24 mol<=0,12 mol
=>0,12M=7,68=>M=64 M là Cu
b) mol O2=2,24/22,4=0,1 mol
Mol hhB=4,256/22,4=0,19 mol
2SO2 + O2 \rightleftharpoons 2SO3
Bđ:0,12 mol;0,1 mol
Pứ::x mol=>0,5x mol=>x mol
Sau:0,12-x mol;0,1-0,5x mol;x mol
Molhh B=0,12-x+0,1-0,5x+x=0,19=>x=0,06 mol
Vậy hh B gồm 0,06 mol SO2 0,07 mol O2 0,06 mol SO3 =>%V
c) mol Fe=6,72/56=0,12 mol
Mol Cu=7,84/64=0,1225 mol
mcr sau pứ=8,8g>mCu=>Cu chưa pư vs axit, Fe pứ 1phần
Fe \rightarrow Fe+3 +3e
x mol. => 3x mol
S+6 +2e \rightarrow S+4
3x mol=>1,5x mol
2Fe3+ + Fe \rightarrow 3Fe2+
x mol=>0,5 x mol
Fe dư:0,12-1,5x mol=>mFe=6,72-84x
mcr=8,8=6,72-84x+7,84=>x=0,06857 mol=>mol SO2=0,103 mol=>V=2,304l
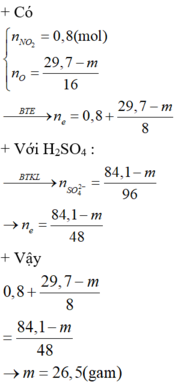
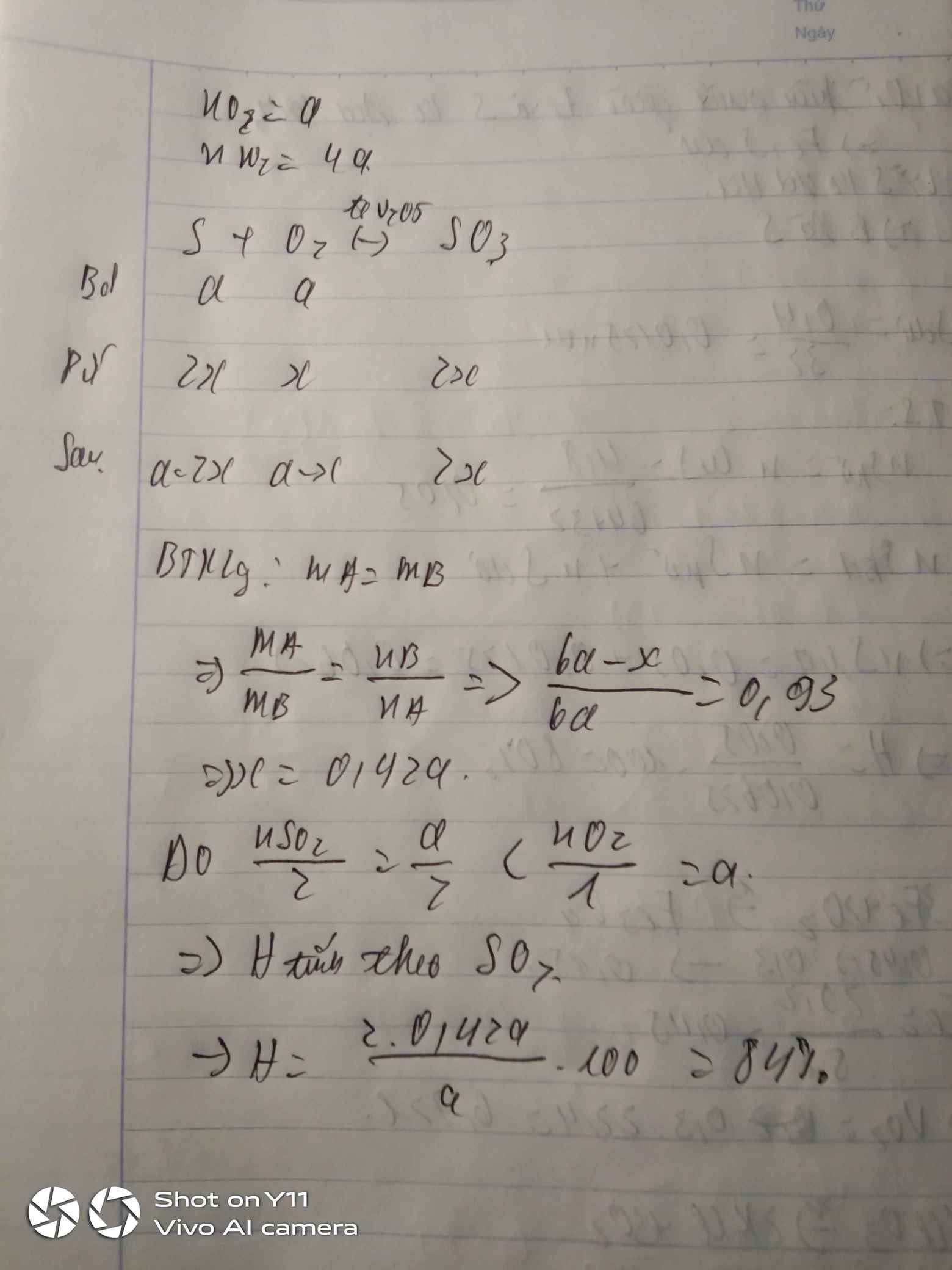


Đề hỏi gì bn nhỉ
viết các pthh xảy ra ạ em ghi thiếu