Trộn 6,48 gam Al với 24 gam Fe2O3. Thực hiện phản ứng nhiệt nhôm thu được chất rắn A. Khi cho A tác dụng với dd NaOH dư, có 1,344 lít khí (đktc) thoát ra. Tính hiệu suất của phản ứng nhiệt nhôm.
A. 83,33%
B. 50,33%
C. 66,67%
D. 75%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Al}=\dfrac{6,48}{27}=0,24\left(mol\right)\)
\(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\)
PTHH: \(2Al+Fe_2O_3\underrightarrow{t^o}Al_2O_3+2Fe\)
Xét tỉ lệ: \(\dfrac{0,24}{2}>\dfrac{0,1}{1}\) => Hiệu suất tính theo Fe2O3
Gọi số mol Fe2O3 phản ứng là a (mol)
\(n_{H_2}=\dfrac{2,688}{22,4}=0,12\left(mol\right)\)
PTHH: 2Al + Fe2O3 --to--> Al2O3 + 2Fe
2a<----a
2Al + 2NaOH + 2H2O --> 2NaAlO2 + 3H2
0,08<------------------------------------0,12
=> 2a + 0,08 = 0,24
=> a = 0,08 (mol)
=> \(H\%=\dfrac{0,08}{0,1}.100\%=80\%\)

Đáp án D
8 Al + 3 Fe 3 O 4 → t o 4 Al 2 O 3 + 9 Fe
Khối lượng nhôm giảm chính là khối lượng nhôm đã tham gia phản ứng.
⇒ n Al phan ung = 0 , 81 27 = 0 , 03 ⇒ n Fe 3 O 4 = 3 8 n Al phan ung = 0 , 01125
Vì A tác dụng với dung dịch NaOH có H2 nên A có chứa Al dư và
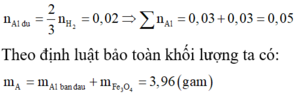

2Al + F e 2 O 3 → A l 2 O 3 + 2Fe
Sau phản ứng cho hỗn hợp rắn tác dụng với dd NaOH thấy có khí thoát ra, suy ra có Al dư.
Vậy hỗn hợp rắn: Fe, A l 2 O 3 , Al (dư) và F e 2 O 3 (nếu dư).
Theo định luật bảo toàn khối lượng, ta có:
m X = m r ắ n tan + m r ắ n k h ô n g tan
= 21,67 - 12,4 = 9,27g
Mà m r ắ n tan = m A l d u + m A l 2 O 3
2Al + 2NaOH + 2 H 2 O
→ 2 N a A l O 2 + 3 H 2 1
Theo PTHH (1), ta có:
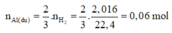
⇒ m A l d u = 0,06.27 = 1,62g
⇒ m A l 2 O 3 p u = m r a n tan - m A l d u
= 9,27-1,62=7,65 g
⇒ n A l 2 O 3 p u = 0,075mol
⇒ n A l p u = n F e s p = 2 n A l 2 O 3 p u
= 0,075.2 = 0,15 mol
Ta có:
m ran khong tan = mFe (sp) = mFe2O3(neu dư)
⇒ m F e 2 O 3 (neu dư)=12,4-0,15.56 = 4g
⇒ n F e 2 O 3 dư = 4/160 = 0,025 mol
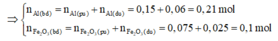
Giả sử phản ứng hoàn toàn thì Al sẽ dư → Tính hiệu suất phản ứng nhiệt nhôm theo F e 2 O 3 .
⇒ H = 0,075.100/0,1 = 75%
⇒ Chọn D.
Đáp án A