Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Al}=\dfrac{6,48}{27}=0,24\left(mol\right)\)
\(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\)
PTHH: \(2Al+Fe_2O_3\underrightarrow{t^o}Al_2O_3+2Fe\)
Xét tỉ lệ: \(\dfrac{0,24}{2}>\dfrac{0,1}{1}\) => Hiệu suất tính theo Fe2O3
Gọi số mol Fe2O3 phản ứng là a (mol)
\(n_{H_2}=\dfrac{2,688}{22,4}=0,12\left(mol\right)\)
PTHH: 2Al + Fe2O3 --to--> Al2O3 + 2Fe
2a<----a
2Al + 2NaOH + 2H2O --> 2NaAlO2 + 3H2
0,08<------------------------------------0,12
=> 2a + 0,08 = 0,24
=> a = 0,08 (mol)
=> \(H\%=\dfrac{0,08}{0,1}.100\%=80\%\)

Đáp án D
8 Al + 3 Fe 3 O 4 → t o 4 Al 2 O 3 + 9 Fe
Khối lượng nhôm giảm chính là khối lượng nhôm đã tham gia phản ứng.
⇒ n Al phan ung = 0 , 81 27 = 0 , 03 ⇒ n Fe 3 O 4 = 3 8 n Al phan ung = 0 , 01125
Vì A tác dụng với dung dịch NaOH có H2 nên A có chứa Al dư và
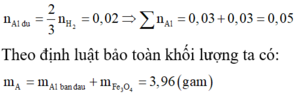

Đáp án A
n Al dư = 2nH2 / 3 = 0,1 mol
⇒ H = (0,25 – 0,1)/0,25 .100%= 60%
2Al + Fe2O3 → Al2O3 +2Fe
0,15
⇒ mZ = 160.(0,15 – 0,075) + 56.0,15 = 20,4 g
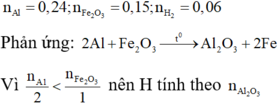
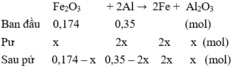


Đáp án A