Cho 11,2g kim loại X tác dụng hết với H2SO4 đặc, nóng thu được 6,72 lít khí SO2 (đktc). Tên kim loại là:
A. đồng
B. sắt
C. kẽm
D. nhôm
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Số mol các chất là:
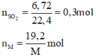
Gọi hoá trị của M là n
Sơ đồ phản ứng: M 0 + H 2 S + 6 2 O 4 ( đặc ) → M + N 2 ( SO 4 ) n + S + 4 O 2 + H 2 O
Các quá trình nhường, nhận electron:
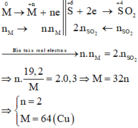

\(n_{H2\left(dktc\right)}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
a) Pt : \(2R+3H_2SO_4\rightarrow R_2\left(SO_4\right)_3+3H_2|\)
2 3 1 3
0,2 0,3
\(n_R=\dfrac{0,3.2}{3}=0,2\left(mol\right)\)
⇒ \(M_R=\dfrac{5,4}{0,2}=27\left(dvc\right)\)
Vậy kim loại R là nhôm
b) \(2Al+6H_2SO_{4\left(đặc,nóng\right)}\rightarrow Al_2\left(SO_4\right)_3+3SO_2+6H_2O|\)
2 6 1 3 6
0,2 0,3
\(n_{SO2}=\dfrac{0,3.3}{2}=0,3\left(mol\right)\)
\(V_{SO2\left(dktc\right)}=0,3.22,4=6,72\left(l\right)\)
Chúc bạn học tốt
a) PTHH: \(2R+3H_2SO_4\rightarrow R_2\left(SO_4\right)_3+3H_2\uparrow\)
Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\) \(\Rightarrow n_R=0,2\left(mol\right)\)
\(\Rightarrow M_R=\dfrac{5,4}{0,2}=27\) \(\Rightarrow\) R là Nhôm (Al)
b) PTHH: \(2Al+6H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}Al_2\left(SO_4\right)_3+3SO_2\uparrow+6H_2O\)
Theo PTHH: \(n_{SO_2}=0,3\left(mol\right)\) \(\Rightarrow V_{SO_2}=0,3\cdot22,4=6,72\left(l\right)\)

Cho 11,2g kim loại R hóa trị II tác dụng hết trong dung dịch axit sunfuric (H2SO4), sau phản ứng thu được 4,48 lít khí hiđro (đktc). Tên của kim loại R là:
A. Sắt. B. Magie. C. Niken. D. Kẽm.
Giai chi tiet :
nH2 = 4,48 : 22,4 = 0,2 (mol)
pthh : R + 2HCl --> RCl2 + H2
0,2 <--------------------- 0,2 (mol )
=> MR= 11,2 : 0,2 = 56 (g/mol)
=> R : Fe

$n_{Fe} = \dfrac{11,2}{56} = 0,2(mol)$
$2Fe +6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O$
$n_{SO_2} = \dfrac{3}{2}n_{Fe} = 0,3(mol)$
$n_{SO_2\ hao\ hụt} = 0,3.3\% = 0,009(mol)$
$V_{SO_2} = (0,3 - 0,009).22,4 = 6,5184(lít)$
2Fe+6H2SO4→Fe2(SO4)3+3SO2+6H2O
nFe=0,2mol
→nSO2=3/2nFe=0,3mol
→VSO2=0,3×22,4−3%=6,69l
Đáp án B
Gọi hóa trị của kim loại là a.
nSO2 = 0,3 mol
Bảo toàn e: nX.a = 2. nSO2
=> nX = 0,6/a
Mặt khác mX = 11,2 => MX = 56a/3
Với a = 3 MX = 56 (Fe)