Dung dịch X gồm 0,3 mol K+; 0,6 mol Mg2+; 0,3 mol Na+; 0,6 mol Cl- và a mol Y2-. Cô cạn dung dịch X, thu được m gam muối khan. Ion Y2- và giá trị của m là
A. SO42- và 169,5.
B. CO32- và 126,3.
C. SO42- và 111,9.
D. CO32- và 90,3.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn C
Loại B, C vì CO32- tạo kết tủa với Mg2+. Như vậy Y2- là SO42-.
Bảo toàn điện tích ⇒ 0,3 + 0,6.2 + 0,3 = 0,6 + 2a ⇒ a = 0,6
⇒ m = 0,3.39 + 0,6.24 + 0,3.23 + 0,6.35,5 + 0,6.96 = 111,9

Đáp án : C
Y không thể là CO32- vì sẽ kết tủa Mg2+ => Y2- là SO42-
Bảo toàn điện tích : nK + 2nMg + nNa = nCl + 2nSO4
=> nSO4 = 0,6 mol
=> m = 111,9g

Muối thu đk:: Na+ :0,3mol , K+ :0,1mol , SO42- :0,2 mol → m=30g

Bảo toàn điện tích cho dung dịch X
2nSO4(2-) = 0,1.2+0,2=0,4(mol)
=> nSO4(2-) = 0,2(mol)
Bảo toàn điện tích cho dung dịch Y
nOH- = nNa+ + 2nBa2+ = 0,3 +2.0,1=0,5(mol)
OH- + H+ -> H2O
0,2......0,2 (mol)
Ba2+ + SO4 2- -> BaSO4
0,1.........0,1 .........0,1 (mol)
Fe2+ + 2OH- -> Fe(OH)2
0,1.........0,2 .......0,1 (mol)
mkết tủa = 0,1.233 + 0,1.90=32,3(g)
BTĐT X : 2.0,1+ 0,2=2.nSO4 2-
=> nSO4 2-=0.2
BTĐT Y : 0,3 + 0,1.2=nOH-
=>nOH-=0,5
H+ + OH- ---> H2O
0,2-----0,2
Ba2+ SO4 2- ----> BaSO4
0,1--------------------0,1
Fe2+ + 2OH------> Fe(0h)2
0,1-------------------0,1
mkết tủa = 0,1.233+ 0,1.90=32,3

Chọn đáp án A.
Bảo toàn điện tích có:
x = 0 , 2 + 2 . 0 , 3 - 0 , 2 = 0 , 6 m o l

Chọn đáp án A.
Bảo toàn điện tích có x = 0,2 + 2.0,3 - 0,2 = 0,6 mol

Định hướng tư duy giải
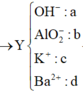

=> 0,3.35,5 + 96(0,06 – d) + 39c + 9(0,42 – 2d – c) = 22,35
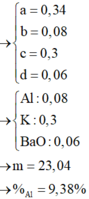
Loại B, C vì CO32- tạo kết tủa với Mg2+. Như vậy Y2- là SO42-.
Bảo toàn điện tích → 0,3 + 0,6.2 + 0,3 = 0,6 + 2a → a = 0,6
→ m = 0,3.39 + 0,6.24 + 0,3.23 + 0,6.35,5 + 0,6.96 = 111,9
Đáp án C