Cho phương trình hóa học: aAl + bH2SO4 → cAl2(SO4)3 + dSO2 + eH2O. Tỉ lệ a:b là
A.1: 2
B. 1:3
C. 1:1
D. 2:3
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Quan sát phương trình phản ứng ta thấy Fe tăng từ mức oxi hóa 0 lên mức oxi hóa +3; S giảm từ mức oxi hóa +6 xuống mức oxi hóa +4 → Fe là chất khử và H2SO4 là chất oxi hóa.
2x F e 0 → F e 3 + + 3 e
3x 4 H + + S + 6 O 4 2 - + 2 e → S + 4 O 2 + 2 H 2 O
Suy ra phương trình phản ứng đã cân bằng như sau:
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ +6H2O
Chọn đáp án A

Đáp án A
Quá trình oxi hóa - khử:
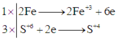
Kết quả
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O
⇒ a : b = n Fe : N H 2 SO 4 = 1 : 3
Chọn đáp án B.
Quan sát phương trình phản ứng ta thấy số oxi hóa của Al tăng từ 0 lên +3; số oxi hóa của S giảm từ +6 xuống +4 → Al là chất khử và H2SO4 là chất oxi hóa
2 x A l 0 → A l + 3 + 3 e
3 x S + 6 + 2 e → S + 4
Suy ra phương trình phản ứng đã cân bằng như sau:
2Al + 6H2SO4 → Al2(SO4)3 + 3SO2 + 6H2O