Đốt cháy hoàn toàn 0,33 mol hỗn hợp X gồm metyl propionat, metyl axetat và 2 hidrocacbon mạch hở cần vừa đủ 1,27 mol O2 tạo ra 14,4g H2O. Nếu cho 0,33 mol X vào dung dịch Br2 dư thì số mol Br2 phản ứng tối đa là:
A. 0,4
B. 0,33
C. 0,3
D. 0,26
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
chú ý: gọi k là số π trong X thì ∑nCO2 – ∑nH2O = (k – 1)nX
→ nπ trong X – nX = ∑nCO2 – ∑nH2O (phân biệt số mol π và số π nhé.!).
đặt x = ngốc –COO trong X thì ∑nO trong X = 2x mol và nπCO trong X = x mol.
Bảo toàn O phương trình đốt cháy có ∑nCO2 = 0,87 + x mol.
Theo đó nπ trong X = 0,4 + x mol. Thật chú ý: π trong X gồm πC=C phản ứng được với Br2
(1πC=C + 1Br) và πCO (trong COO không phản ứng được với Br2).
→ Rõ luôn số mol Br2 phản ứng với 0,33 mol X là 0,4 mol. Chọn đáp án D

Đáp án D
X ( 0 , 33 m o l ) C 3 H 6 O 2 C 4 H 8 O 2 C x H y ( a m o l ) + O 2 ( 1 , 27 m o l ) → H 2 O ( 0 , 8 m o l ) + C O 2
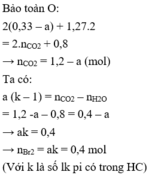

Chọn A.
Quy đổi:
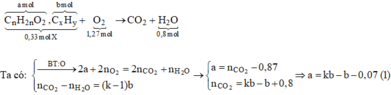
với k là số liên kết p trong phân tử của 2 hiđrocacbon).
Kết hợp (1) với a + b = 0,33 ta suy ra: kb = 0,4 mol
Khi cho 0,33 mol X tác dụng với Br2 thì: n B r 2 = k n C x H y = k b = 0 , 4 m o l
Gọi k là số liên kết π trong X => nCO2 – nH2O = (k – 1).nX
=> nπ(X) – nX = nCO2 – nH2O
Đặt x là số mol gốc COO có trong X => nO(X) = 2x mol và nπ (COO) = x mol
- Khi đốt cháy X: Bảo toàn Oxi: nO(X) + 2nO2 = 2nCO2 + nH2O
=> 2x + 2.1,27 = 2nCO2 + 0,8
=> nCO2 = (0,87 + x) mol
=> nπ (X) = nCO2 – nH2O + nX = (0,87 + x) – 0,8 + 0,33 = 0,4 + x
Vì chỉ có liên kết π ngoài COO mới phản ứng được với Br2
=> nπ (gốc hidrocacbon) = nπ (X) – nπ (COO) = (0,4 + x) – x = 0,4 mol
=> nBr2 = 0,4 mol
Đáp án cần chọn là: A