Thể tích khí clo cần phản ứng với kim loại M bằng 1,5 lần lượng khí sinh ra khi cho cùng lượng kim loại đó tác dụng hoàn toàn với dung dịch axit HCl dư trong cùng điều kiện. Khối lượng muối clorua sinh ra trong phản ứng với clo gấp 1,2886 lần lượng sinh ra trong phản ứng với axit HCl. Xác định kim loại M
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi n, m là hóa trị của R khi tác dụng HNO3 và H2SO4 loãng ( 1≤ m≤ n≤ 3)
Chọn nR= 1 mol
2R + mH2SO4 →R2(SO4)m + mH2↑
1 → 0,5 0,5m
R + 2nHNO3 →R(NO3)n + nNO2 + nH2O
1 1 n
Ta có: n=3.0,5m n=1,5m m=2, n=3 là phù hợp.
Ta có: (R + 96)=(R + 186). 0,6281 R=56 R là Fe.
Đáp án B

\(M+mHCl\rightarrow MCl_m+\frac{m}{2}H_2\)
\(M+\frac{n}{2}Cl_2\rightarrow MCl_n\)
Giải hệ PT:
\(\left\{{}\begin{matrix}\frac{n}{2}+1,5\frac{m}{2}\\n,m=1,2,3\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}n=3\\m=2\end{matrix}\right.\)
\(M+106,5=1,2886\left(M+71\right)\)
\(\Rightarrow M=52\left(Cr\right)\)
Đáp án đúng B

Bài 1:
a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\) (1)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\) (2)
b, Giả sử: mZn = mAl = a (g)
\(\Rightarrow\left\{{}\begin{matrix}n_{Zn}=\dfrac{a}{65}\left(mol\right)\\n_{Al}=\dfrac{a}{27}\left(mol\right)\end{matrix}\right.\)
Theo PT: \(\left\{{}\begin{matrix}n_{H_2\left(1\right)}=n_{Zn}=\dfrac{a}{65}\left(mol\right)\\n_{H_2\left(2\right)}=n_{Al}=\dfrac{a}{27}\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{H_2\left(1\right)}< n_{H_2\left(2\right)}\)
Vậy: Al cho nhiều khí H2 hơn.
c, Giả sử: nH2 (1) = nH2 (2) = b (mol)
Theo PT: \(\left\{{}\begin{matrix}n_{Zn}=n_{H_2\left(1\right)}=b\left(mol\right)\\n_{Al}=n_{H_2\left(2\right)}=b\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Zn}=65b\left(g\right)\\m_{Al}=27b\left(g\right)\end{matrix}\right.\)
\(\Rightarrow m_{Zn}>m_{Al}\)
Vậy: Khối lượng Al đã pư nhỏ hơn.
Bài 2:
PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
a, Ta có: \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{9,8}{98}=0,1\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,1}{1}\), ta được Fe dư.
Theo PT: \(n_{Fe\left(pư\right)}=n_{H_2SO_4}=0,1\left(mol\right)\)
\(\Rightarrow n_{Fe\left(dư\right)}=0,1\left(mol\right)\Rightarrow m_{Fe\left(dư\right)}=0,1.56=5,6\left(g\right)\)
b, Theo PT: \(n_{H_2}=n_{H_2SO_4}=0,1\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)
Bạn tham khảo nhé!

a, PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT: \(n_{HCl}=2n_{H_2}=0,6\left(mol\right)\)
\(\Rightarrow m_{HCl}=0,6.36,5=21,9\left(g\right)\)
b, Theo PT: \(n_{Al}=\dfrac{2}{3}n_{H_2}=0,2\left(mol\right)\)
\(\Rightarrow m_{Al}=0,2.27=5,4\left(g\right)\)

\(PTHH:2Al+6HCl->2AlCl_3+3H_2\)
0,2<--0,6<----------0,2<------0,3 (mol)
\(n_{H_2\left(dktc\right)}=\dfrac{V}{22,4}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(m_{HCl}=n\cdot M=0,6\cdot\left(1+35,5\right)=21,9\left(g\right)\)
\(m_{AlCl_3}=n\cdot M=0,2\cdot\left(27+35,5\cdot3\right)=26,7\left(g\right)\)
a, PT: 2Al+6HCl→2AlCl3+3H2
Ta có: nH2=6,7222,4=0,3(mol)
Theo PT: nHCl=2nH2=0,6(mol)
⇒mHCl=0,6.36,5=21,9(g)
b, Theo PT: nAl=23nH2=0,2(mol)
⇒mAl=0,2.27=5,4(g)

a) Phương trình phản ứng:
Zn + H2SO4 → ZnSO4 + H2
Fe + H2SO4loãng → FeSO4 + H2
2Al+ 3H2SO4 → Al2(SO4)3 + 3H2
b) Giả sử cho cùng một khối lượng là a g kim loại kẽm sắt và nhôm
Zn + H2SO4 → ZnSO4 + H2 (1)
Fe + H2SO4loãng → FeSO4 + H2 (2)
2Al+ 3H2SO4 → Al2(SO4)3 + 3H2 (3)
Ta có 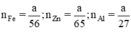
Theo pt nH2 (1) = nZn = 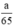 mol
mol
nH2 (2) = nFe = 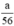 mol
mol
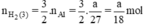
Như vậy ta nhận thấy 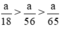 ⇒ nH2 (3) > nH2 (2) > nH2 (1)
⇒ nH2 (3) > nH2 (2) > nH2 (1)
Như vậy cho cùng một lượng kim loại tác dụng với axit H2SO4 loãng dư thì nhôm cho nhiều khí hidro hơn, sau đó đến sắt và ít nhất là kẽm
c) Nếu thu được cùng một lượng khí hidro thì khối lượng kim loại ít nhất là nhôm, sau đó đến sắt, cuối cùng là kẽm.


Phương trình hóa học của phản ứng:
M + n/2HCl → M Cl n
M + mHCl → M Cl m + m/2 H 2
Theo đề bài, ta có:
và M + 106,5 = 1,2886 (M+71)
Giải ra, ta có M = 52 (Cr)