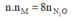Cho 3,024 gam một kim loại M tan hết trong dung dịch HNO3 loãng, thu được 940,8 ml khí NxOy (sản phẩm khử duy nhất ở đktc) có tỉ khối đối với H2 bằng 22. Khí NxOy và kim loại M là:
A. NO và Mg
B. N2O và Al
C. N2O và Fe
D. NO2 và Al
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
MKhí = 22 chứng tỏ NxOy là N2O duy nhất
nN2O = 0,042 mol
2N+5+ 8e → N2O M→Mn++ne
0,336 0,042
BT e ⇒ne = 0,036 mol⇒nM = 0,036 /n
Khi đó M=3,024/ (0,336:n)
M=9n ⇒ n=3, M=27⇒ Chọn Al

\(\dfrac{d_k}{d_{H2}}=22\) => dk = 44 => NxOy là N2O
Ta có: nN2O = 0,03 mol
Gọi n là hóa trị của kim loại M
Bảo toàn e: \(\dfrac{2,16}{M}.n\) = nN2O . 8 = 0,24
Vì M là kim loại nên n ∈ \(\left\{1;2;3\right\}\)
Thay các giá trị của n thì được n = 3 cho M = 27 là thỏa mãn
=> M là Al

MNxOy = 22.2 = 44(g/mol)
=> N2O
\(n_{N_2O}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Gọi số mol của M và Al là a, 2a
=> a.M + 54a = 7,8 (1)
M0 - ne --> M+n
a--->an
Al0 -3e --> Al+3
2a->6a
2N+5 +8e --> N2+1
_____0,8<--0,1
Bảo toàn e: an + 6a = 0,8
=> \(a=\dfrac{0,8}{n+6}\) (2)
Thay (2) vào (1), ta có:
\(\dfrac{0,8.M}{n+6}+54.\dfrac{0,8}{n+6}=7,8\)
=> 0,8.M + 43,2 = 7,8(n+6)
=> M = \(\dfrac{39}{4}n+\dfrac{9}{2}\)
Xét n = 1 => L
Xét n = 2 => M = 24(Mg)

Câu 3: Cho 4 gam oxit kim loại M tác dụng với dung dịch HCl dư thu được 9,5 gam muối. Kim loại M là
A. Mg. B. Ca. C. Zn. D. Cu.
Câu 4: Hòa tan 20,88 gam oxit kim loại M trong H2SO4 loãng dư thu được 49,68 gam muối. Kim loại M là
A. Fe. B. Zn. C. Cu. D. Mg.
Câu 5: Cho 1,67 gam hỗn hợp gồm hai kim loại ở 2 chu kỳ liên tiếp thuộc nhóm IIA (phân nhóm chính nhóm II) tác
dụng hết với dung dịch HCl (dư), thoát ra 0,672 lít khí H2 (ở đktc). Hai kim loại đó là
A. Ca và Sr. B. Sr và Ba.
C. Mg và Ca. D. Be và Mg.
Câu 6: Cho 3,024 gam một kim loại M tan hết trong dung dịch HNO3 loãng, thu được 940,8 ml khí NxOy (sản phẩm khử
duy nhất, ở đktc) có tỉ khối đối với H2 bằng 22. Khí NxOy và kim loại M là
A. NO2 và Al. B. N2O và Al.
C. NO và Mg. D. N2O và Fe
Câu 7: Hòa tan hoàn toàn 3 gam hỗn hợp X gồm hai kim loại kiềm A và B ở 2 chu kì liên tiếp nhau trong bảng tuần hoàn
(MA < MB) vào nước dư, sau phản ứng thu được 2,24 lít khí H2 (đktc). Hai kim loại đó là
A. Li, Na. B. Na, K.
C. K, Rb. D. Rb, Cs.
Câu 8: Hòa tan 10,8 gam kim loại M vào H2SO4 đặc nóng dư thu được 3,78 lít khí SO2 (sản phẩm khử duy nhất ở đktc).
Kim loại M là
A. Ag. B. Cu. C. Mg. D. Al.
Câu 9: Hòa tan 10,8 gam kim loại M vào H2SO4 đặc nóng dư thu 2,52 lít khí H2S (sản phẩm khử duy nhất ở đktc). Kim loại
M là
A. Ag. B. Cu. C. Mg. D. Al.

Đáp án C
Đặt số mol 2 kim loại lần lượt là a và b ta có:
+ PT theo khối lượng hh: 24a + 27b = 1,86 (1).
+ PT theo bảo toàn số mol e cho nhận: 2a + 3b = 8nN2O = 0,2 (2).
● Giải hệ (1) và (2) ta có nMg = a = 0,01 mol.
⇒ %mMg = 0 , 01 × 24 1 , 86 × 100 = 12,9%

Đáp án C
Đặt số mol 2 kim loại lần lượt là a và b ta có:
+ PT theo khối lượng hh: 24a + 27b = 1,86 (1).
+ PT theo bảo toàn số mol e cho nhận:
2a + 3b = 8nN2O = 0,2 (2).
● Giải hệ (1) và (2) ta có nMg = a = 0,01 mol.
⇒ %mMg = 12,9%

Đáp án C
Đặt số mol 2 kim loại lần lượt là a và b ta có:
+ PT theo khối lượng hh: 24a + 27b = 1,86 (1).
+ PT theo bảo toàn số mol e cho nhận: 2a + 3b = 8nN2O = 0,2 (2).
● Giải hệ (1) và (2) ta có nMg = a = 0,01 mol.
![]()

Ta có nNO= 0,15 mol
QT nhận e:
NO3-+ 3e+ 4H+ → NO+ 2H2O
Ta có nNO3- trong muối= ne= 3.nNO= 3.0,15= 0,45 mol
→mmuối nitrat= mkim loại+ mNO3-trong muối= m+ 0,45.62= m+27,9 (gam)
Đáp án D
Đáp án B:
có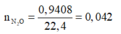
Gọi n là hóa trị của kim loại M. Các quá trình nhuờng và nhận electron:
Quá trình nhường electron: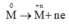
Quá trình nhận electron: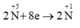
Áp dụng định luật bảo toàn mol electron, ta có: