cho 23,1 gam hỗn hợp bột Mg và Al ( tỉ lệ mol 1:1,25) phản ứng hết với ding dịch hỗn hợp gồm NaNO3 và NaHSO4 thu được dung dịch X chứa m gam muối trung hòa và 6,72 lít (đktc) hỗn hợp khí Y gồm N2O và H2 có tỉ khối so với H2 bằng 11,5.Tính m.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án : B
nZn = nMg = 0,35 mol
Vì có H2 => NO3 ; H+ hết. Chỉ có muối sunfat trung hòa
MY = 23 , nY = 0,2 mol => nN2O = nH2 = 0,1 mol
Giả sử có NH4+ => bảo toàn e : 2nZn + 2nMg = 2nH2 + 8nN2O + 8nNH4+
=> nNH4+ = 0,05 mol
Bảo toàn N : nNaNO3 = nNH4+ + 2nN2O = 0,25 mol
X có : 0,35 mol Zn2+ ; 0,35 mol Mg2+ ; 0,05 mol NH4+ ; (x + 0,25) mol Na+ và x mol SO42-
Bảo toàn điện tích : 0,35.2 + 0,35.2 + 0,05 + (x + 0,25) = 2x
=> x = 1,7 mol
=> m = mion = 240,1g

Đáp án B
Đặt nN2O = nH2 = a (mol)
nNH4+ = b (mol)
=> nH+ = 10nN2O + 2nH2 + 10 nNH4+ = 12a + 10b
=> nNa+ = 12a + 10b + 0,06 ; nSO42- = 12a + 10b
nMg = nMg(OH)2 = 0,24 (mol)
Bảo toàn electron: 2nMg + 3nAl = 8nN2O + 2nH2 + 8nNH4+
=> nAl = (10a + 8b – 0,48)/3
BTNT N => 3nAl(NO3)3 + nNaNO3 = 2n N2O + nNH4+
=> nAl(NO3)3 = (2a + b – 0,06)/3
BTNT Al => nAl3+ trong X = nAl + nAl(NO3) = 4a + 3b – 0,18
Khối lượng muối trong X( Na+ ; Al3+; Mg2+; NH4+ ; SO42- ):
23( 12a + 10b + 0,06) + 27 ( 4a + 3b – 0,18) + 0,24.24 + 18b + 96 ( 12a + 10b) = 115, 28 (1)
nNaOH = 4nAl3+ + 2nMg2+ + nNH4+
=> 0,92 = 4 ( 4a + 3b – 0,18 ) + 2.024 + b (2)
Từ (1) và (2) => a = b = 0,04 (mol)
=> nT = 2a = 0,08 (mol)
=> V= 1,792 (lít)

Đáp án D
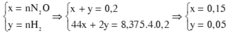
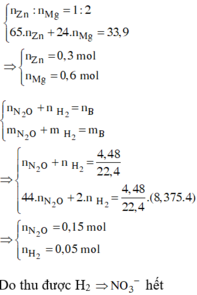
nZn = a => nMg = 2a => 65a + 24.2a = 33,9 => a = 0,3
Bảo toàn ne => 2nZn + 2nMg = 8nN2O + 2nH2 + 8nNH4+ => nNH4+ = 0,0625
Bảo toàn N => nNaNO3 = 2nN2O + nNH4+ = 0,3625
nH+ = 10nN2O + 2nH2 + 10nNH4+ = 2,225 => nNaHSO4 = 2,225
Bảo toàn H => nNaHSO4 = 2nH2 + 4nNH4+ + 2nH2O => nH2O = 0,9375
Bảo toàn khối lượng => mmuối = mkim loại + mNaNO3 + mNaHSO4 – mB – mH2O
= 33,9 + 0,3625.85 + 2,225.120 – 0,2.8,375.4 – 0,93 75.18 = 308,1375g

Đáp án D
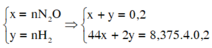
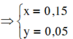
nZn = a => nMg = 2a => 65a + 24.2a = 33,9 => a = 0,3
Bảo toàn ne=> 2nZn + 2nMg = 8nN2O + 2nH2 + 8nNH4+ =>nNH4+ = 0,0625
Bảo toàn N => nNaNO3 = 2nN2O + nNH4+ = 0,3625
nH+ = 10nN2O + 2nH2 + 10nNH4+ = 2,225=>nNaHSO4 = 2,225
Bảo toàn H => nNaHSO4 = 2nH2 + 4nNH4+ + 2nH2O => nH2O = 0,9375
Bảo toàn khối lượng =>mmuối = mkim loại + mNaNO3 + mNaHSO4 – mB – mH2O
= 33,9 + 0,3625.85 + 2,225.120 – 0,2.8,375.4 – 0,93 75.18 = 308,1375g

Chọn D.
Hỗn hợp Mg, Al và Al(NO)3 tác dụng với dung dịch chứa NaHSO4 (x mol) và 0,06 mol NaNO3.
Dung dịch X gồm
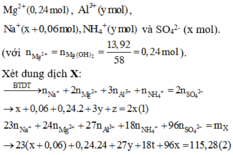
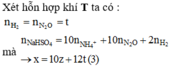
Xét dung dịch thu được sau khi cho X tác dụng với dung dịch chứa 0,92 mol NaOH, ta có:
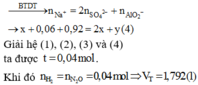

Đáp án C
Gọi số mol N2O và H2 là a mol, NH4+ có thể tạo ra là b mol.
Bảo toàn H+:


Đáp án : D
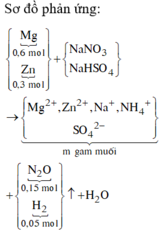
nZn = 0,3 ; nMg = 0,6 mol
,nB = 0,2 mol ; MB = 33,5 => Do có H2 nên NO3 hết trước H+ ; muối trung hòa chỉ có anion SO42-
=> nN2O = 0,15 ; nH2 = 0,05 mol
Bảo toàn e : 2nZn + 2nMg = 8nN2O + 2nH2 + 8nNH4+
=> nNH4+ = 0,0625 mol
Bảo toàn N : nNaNO3 = nNH4 + 2nN2O = 0,3625 mol
Nếu nNaHSO4 = x mol
Sau phản ứng còn : (x + 0,3625 mol ) Na+ ; 0,3 mol Zn2+ ; 0,6 mol Mg2+ ; 0,0625 mol NH4+ ; x mol SO42-
Bảo toàn điện tích : x = 2,225 mol
=> m = 308,1375g


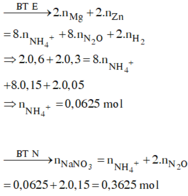


Giả sử số mol Mg là x\(\Rightarrow n_{Al}=1,25x\)(mol)
\(\Rightarrow24x+27\cdot1,25x=23,1\Rightarrow x=0,4\)
Gọi số mol của N2O và H2 là a và b(mol).
Ta có: \(\left\{{}\begin{matrix}a+b=\dfrac{6,72}{22,4}=0,3\\44a+2b=11,5\cdot2\cdot0,3\end{matrix}\right.\)\(\Rightarrow\left\{{}\begin{matrix}a=0,15mol\\b=0,15mol\end{matrix}\right.\)
BTe ta thấy: \(2n_{Mg}+3n_{Al}>8n_{N_2O}+2n_{H_2\Rightarrow}\)dd chứa \(NH^+_4\)
\(\Rightarrow8n_{NH^+_4}=2n_{Mg}+3n_{Al}-8n_{N_2O}-2n_{H_2}\Rightarrow n_{NH^+_4}=0,0625mol\)
Do sinh khí H2 nên toàn bộ lượng NO-3 bị chuyển hóa thành N2O và NH+4.
\(\Rightarrow n_{NaNO_3}=0,15\cdot2+0,0625=0,3625mol\left(BTN\right)\)
\(n_{HSO^-_4}=2n_{H_2}+10n_{N_2O}+10n_{NH^+_4}=2,425mol\)
Dung dịch X chứa:
\(Mg^{2+}:0,4mol\)
\(Al^{3+}:0,5mol\)
\(Na^+:0,3625mol\) \(\Rightarrow m=255,3625\left(g\right)\)
\(SO^{2-}_4:2,425mol\)
\(NH^+_4:0,0625mol\)