Cho 200ml dung dịch HCl 0,8M vào 200ml dung dịch NaOH 1M thu được dung dịch A có pH bằng bao nhiêu?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) ta có : \(\dfrac{NaOH}{\dfrac{0,2}{\dfrac{0,2}{0}}}\dfrac{+}{ }\dfrac{H_2SO_4}{\dfrac{0,12}{\dfrac{0,1}{0,02}}}\dfrac{\rightarrow}{ }\dfrac{Na_2SO_4}{ }\dfrac{+}{ }\dfrac{2H_2O}{ }\)
\(\Rightarrow\dfrac{H_2SO_4}{0,02}\dfrac{\rightarrow}{ }\dfrac{2H^+}{0,04}\dfrac{+}{ }\dfrac{SO_4^{2-}}{ }\) \(\Rightarrow\left[H^+\right]=\dfrac{0,04}{0,4}=0,1\)
ta có : \(pH_B=-\log_{10}0,1=1\)
vậy \(pH\) của dung dịch \(B\) là \(1\)
b) ta có : \(\dfrac{NaOH}{0,2}\dfrac{\rightarrow}{ }\dfrac{Na^+}{ }\dfrac{+}{ }\dfrac{OH^-}{0,2}\)
\(\dfrac{H_2SO_4}{0,12}\dfrac{\rightarrow}{ }\dfrac{2H^+}{0,24}\dfrac{+}{ }\dfrac{SO_4^{2-}}{ }\)
\(\dfrac{Ba\left(OH\right)_2}{0,4}\dfrac{\rightarrow}{ }\dfrac{Ba^+}{ }\dfrac{+}{ }\dfrac{2OH^-}{0,8}\)
\(\Rightarrow\dfrac{H^+}{\dfrac{1}{\dfrac{0,24}{0,76}}}\dfrac{+}{ }\dfrac{OH^-}{\dfrac{0,24}{\dfrac{0,24}{0}}}\dfrac{\rightarrow}{ }\dfrac{H_2O}{ }\)
\(\Rightarrow CM_{OH^-}=\left[OH^-\right]=\dfrac{0,76}{0,6}\simeq1,267\left(M\right)\)
vậy .......................................................................................................

PTHH: \(NaOH+HCl\rightarrow NaCl+H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{NaOH}=0,2\cdot1=0,2\left(mol\right)\\n_{HCl}=0,1\cdot1=0,1\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) NaOH còn dư
\(\Rightarrow\) Dung dịch sau p/ứ có môi trường bazơ
\(\Rightarrow n_{NaCl}=0,1\left(mol\right)=n_{NaOH\left(dư\right)}\) \(\Rightarrow C_{M_{NaCl}}=\dfrac{0,1}{0,2+0,1}\approx0,33\left(M\right)=C_{M_{NaOH\left(dư\right)}}\)

Đáp án B
Số mol AlCl3 là nAlCl3= 0,1.1 = 0,1 (mol)
Số mol Al2O3 là nAl2O3= 2,55/102 = 0,025 (mol)
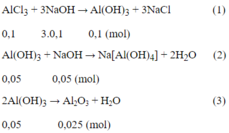
Theo pt (3) ta thấy số mol Al(OH)3 còn lại là 0,05 mol
Như vậy đã có: 0,1 - 0,05 = 0,05 mol Al(OH)3 đã bị hòa tan.
Từ (1) và (2) số mol NaOH = 3.0,1 + 0,05 = 0,35 (mol)
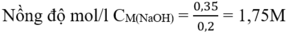

Đáp án D
► Xử lý dữ kiện 200 ml dung dịch Y: nH+ = 0,2 × (0,2 + 0,15 × 2) = 0,1 mol.
pH = 13 ⇒ OH– dư ⇒ [OH–] = 1013 – 14 = 0,1M ⇒ nOH– dư = 0,4 × 0,1 = 0,04 mol.
||⇒ nOH–/Y = 0,04 + 0,1 = 0,14 mol ⇒ 400 ml dung dịch Y chứa 0,28 mol OH–.
► Dễ thấy nOH– = 2nH2 + 2nO/oxit ⇒ nO/oxit = (0,28 – 2 × 0,07) ÷ 2 = 0,07 mol.
||⇒ m = 0,07 × 16 ÷ 0,0875 = 12,8(g)

a.Ta có: nHCl=1.\(\frac{200}{1000}\)=0,2(mol)
Ta có phương trình 2Al + 6HCl -----> 2AlCl3 + 3H2 (1)
Theo phương trình: 2 mol 6 mol 3 mol
Theo đề: x mol 0,2 mol 0,1 mol
=> V\(H_2\)=0,1.22,4=2,24(l)
b. Từ pt (1), ta có:
mAl=x.27=\(\frac{0,2.2}{6}\).27=1,8(g)
c.Từ pt (1), ta có: mHCl=0,2. (1+35,5)=7,3(g)
mdd=\(\frac{200}{1000}.22,4.18=80,64\left(g\right)\)
=>C%=\(\frac{7,3}{80,64}.100\%=9,1\%\)
Ungr hộ nha!
2 câu bạn đăng cơ bản là giống nhau, khác mỗi thông số :v
Dạng này thì bạn cứ tìm số mol của H+ và OH- ra rồi xem cái nào dư thì lấy log của dư là được.
\(n_{H^+}=n_{HCl}=0,2.0,8=0,16\left(mol\right)\)
\(n_{OH^-}=1.0,2=0,2\left(mol\right)\)
=> OH dư \(\Rightarrow pOH=1,4\Rightarrow pH=14-1,4=12,6\)
Giải ngu như chó 🐶