Cho 200g dung dịch H2SO4 9,8% phản ứng với 200g dung dịch KOH 5,6%. Tính C% các chất thu được sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



\(m_{H_2SO_4}=\dfrac{200\cdot9,8\%}{100\%}=19,6\left(g\right)\\ n_{H_2SO_4}=\dfrac{19,6}{98}=0,2\left(mol\right)\\ PTHH:2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O\\ \Rightarrow n_{KOH}=2n_{H_2SO_4}=0,4\left(mol\right)\\ \Rightarrow m_{KOH}=0,4\cdot\left(39+16+1\right)=22,4\left(g\right)\)

\(n_{H_2}=\dfrac{5,6}{22,4}=0,25(mol)\\ Mg+H_2SO_4\to MgSO_4+H_2\\ MgO+H_2SO_4\to MgSO_4+H_2O\\ \Rightarrow n_{Mg}=0,25(mol)\\ a,\begin{cases} \%_{Mg}=\dfrac{0,25.24}{14}.100\%=42,86\%\\ \%_{MgO}=100\%-42,86\%=57,14\% \end{cases}\\ b,n_{MgO}=\dfrac{14-0,25.24}{40}=0,2(mol)\\ \Rightarrow \Sigma n_{H_2SO_4}=0,2+0,25=0,45(mol)\\ \Rightarrow C\%_{H_2SO_4}=\dfrac{0,45.98}{200}.100\%=22,05\%\)

\(m_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\\
m_{H_2SO_4}=200.12,25\%=24,5g\\
n_{H_2SO_4}=\dfrac{24,5}{98}=0,25\\
pthh:Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\\
LTL:0,2< 0,25=>H_2SO_4\left(d\text{ư}\right)Fe\left(h\text{ết}\right)\)
\(n_{H_2}=n_{Fe}=0,2\left(mol\right)\\
V_{H_2}=0,2.22,4=4,48l\)
\(C\%=\dfrac{11,2}{24,5}.100\%=45,7\%\)

a)
Gọi $n_{NaOH} = a(mol) ; n_{KOH} = b(mol) \Rightarrow 40a + 56b = 3,04(1)$
$NaOH + HCl \to NaCl + H_2O$
$KOH + HCl \to KCl + H_2O$
$m_{muối} = 58,5a + 74,5b = 4,15(2)$
Từ (1)(2) suy ra a = 0,02 ; b = 0,04
$n_{HCl} = a + b = 0,06(mol)$
$C\%_{HCl} = \dfrac{0,06.36,5}{200}.100\% = 1,095\%$
b)
$m_{dd} = 3,04 + 200 = 203,4(gam)$
$C\%_{NaCl} = \dfrac{0,02.58,5}{203,4}.100\% = 0,58\%$
$C\%_{KCl} =\dfrac{0,04.74,5}{203,4}.100\% = 1,47\%$

\(PTHH:HCl+KOH\rightarrow KCl+H_2O\)(1)
\(HCl+KHCO_3\rightarrow KCl+H_2O+CO_2\)(2)
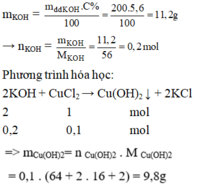
\(n_{KOH}=\frac{200.5,6}{100.56}=0,2\left(mol\right)\)
\(n_{KHCO_3}=\frac{5}{100}=0,05\left(mol\right)\)
Theo PT (1) : \(n_{HCl}=n_{KOH}=0,2\left(mol\right)\)
Theo PT (2) : \(n_{HCl}=n_{KHCO_3}=0,05\left(mol\right)\)
\(\Rightarrow\Sigma n_{HCl}=0,2+0,05=0,25\left(mol\right)\) \(\Rightarrow m_{HCl}=0,25.36,5=9,125\left(g\right)\) \(\Rightarrow a=m_{ddHCl}=\frac{9,125.100}{7,3}=125\left(g\right)\)