Đốt cháy hoàn toàn 4,6g Natri rồi lấy sản phẩm cho vào 120g dd NaOH 25% thu được dd X. Tính C% dd X
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


nNa = 4,6 / 23 = 0,2 (mol)
Na + 2H2O -- > NaOH + H2
mH2 = 0,2.2 =0,4 (g)
dd = mNa + mddH2O - mH2 = 4,6 + 200 - 0,4 = 204,2(g)
mNaOH = 0,2 . 40 = 8(g)
=> \(C\%_{ddA}=\dfrac{8.100}{204,2}=3,9\%\)

\(n_{C_2H_4}=\dfrac{0,672}{22,4}=0,03\left(mol\right)\)
PTHH: \(C_2H_4+3O_2\xrightarrow[]{t^o}2CO_2+2H_2O\)
0,03-------------->0,06
\(n_{NaOH}=0,25.0,2=0,05\left(mol\right)\)
Xét \(T=\dfrac{0,05}{0,06}=\dfrac{5}{6}\) => Tạo muối NaHCO3 và CO2 dư
PTHH: \(NaOH+CO_2\rightarrow NaHCO_3\)
0,05---------------->0,05
\(\rightarrow m_{muối}=0,05.84=4,2\left(g\right)\)

Câu 1.1 : Muối gồm NaHCO3(y mol) ; n Na2CO3(x mol)
Ta có :
106x + 84y = 42,2
2x + y = 0,65.2
=> x = 0,2 ; y = 0,25
=> n CO2 = x + y = 0,45(mol)
m H2O = 29,7 - 0,45.44 = 9,9(gam)
n H2O = 9,9/18 = 0,55(mol)
Gọi n CH4 = a(mol) ; n C2H4 = b(mol) ; n C2H2 = c(mol)
Ta có:
a + b + c = 0,3
a + 2b + 2c = 0,45
2a + 2b + c = 0,55
=> a = 0,15 ; b = 0,1 ; c = 0,05
%V CH4 = 0,15/0,3 .100% = 50%

\(n_{Na}=\dfrac{4,6}{23}=0,2mol\)
\(2Na+2H_2O\rightarrow2NaOH+H_2\)
0,2 0,2 0,2 0,1
\(V_{H_2}=0,1\cdot22,4=2,24l\)
\(m_{NaOH}=0,2\cdot40=8g\)
\(m_{ddNaOH}=4,6+0,2\cdot18-0,1\cdot2=8g\)
\(\Rightarrow C\%=\dfrac{m_{NaOH}}{m_{ddNaOH}}\cdot100\%=\dfrac{8}{8}\cdot100\%=100\%???\)
Sửa đề: Tính nồng độ mol của dung dịch NaOH???
\(C_{M_{NaOH}}=\dfrac{0,2}{0,3}=\dfrac{2}{3}M\)

Giả sử: \(\left\{{}\begin{matrix}n_{CH_4}=x\left(mol\right)\\n_{C_2H_4}=y\left(mol\right)\end{matrix}\right.\)
⇒ 16x + 28y = 7,6 (1)
Ở cùng điều kiện nhiệt độ và áp suất, tỉ lệ thể tích cũng là tỉ lệ số mol.
Ta có: \(\dfrac{V_{CH_4}}{V_{C_2H_4}}=\dfrac{5}{8}\Rightarrow\dfrac{n_{CH_4}}{n_{C_2H_4}}=\dfrac{x}{y}=\dfrac{5}{8}\)
\(\Rightarrow x=\dfrac{5}{8}y\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,125\left(mol\right)=n_{CH_4}\\y=0,2\left(mol\right)=n_{C_2H_4}\end{matrix}\right.\)
BTNT C và H, có: \(\left\{{}\begin{matrix}n_{CO_2}=n_{CH_4}+2n_{C_2H_4}=0,525\left(mol\right)\\n_{H_2O}=\dfrac{4n_{CH_4}+4n_{C_2H_4}}{2}=0,65\left(mol\right)\end{matrix}\right.\)
Ta có: \(n_{OH^-}=2n_{Ca\left(OH\right)_2}=0,8\left(mol\right)\)
\(\Rightarrow\dfrac{n_{OH^-}}{n_{CO_2}}=\dfrac{0,8}{0,525}\approx1,5\)
⇒ Pư tạo CaCO3 và Ca(HCO3)2.
Giả sử: \(\left\{{}\begin{matrix}n_{CaCO_3}=a\left(mol\right)\\n_{Ca\left(HCO_3\right)_2}=b\left(mol\right)\end{matrix}\right.\)
BTNT Ca và C, có: \(\left\{{}\begin{matrix}a+b=0,525\\a+2b=0,8\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,25\left(mol\right)\\b=0,275\left(mol\right)\end{matrix}\right.\)
Có: m thêm vào dd = mCO2 + mH2O = 34,8 (gam)
Mà: m↓ = mCaCO3 = 0,25.100 = 25 (g)
Vậy: Dung dịch thu được tăng và tăng: 34,8 - 25 = 9,8 (g)
Bạn tham khảo nhé!
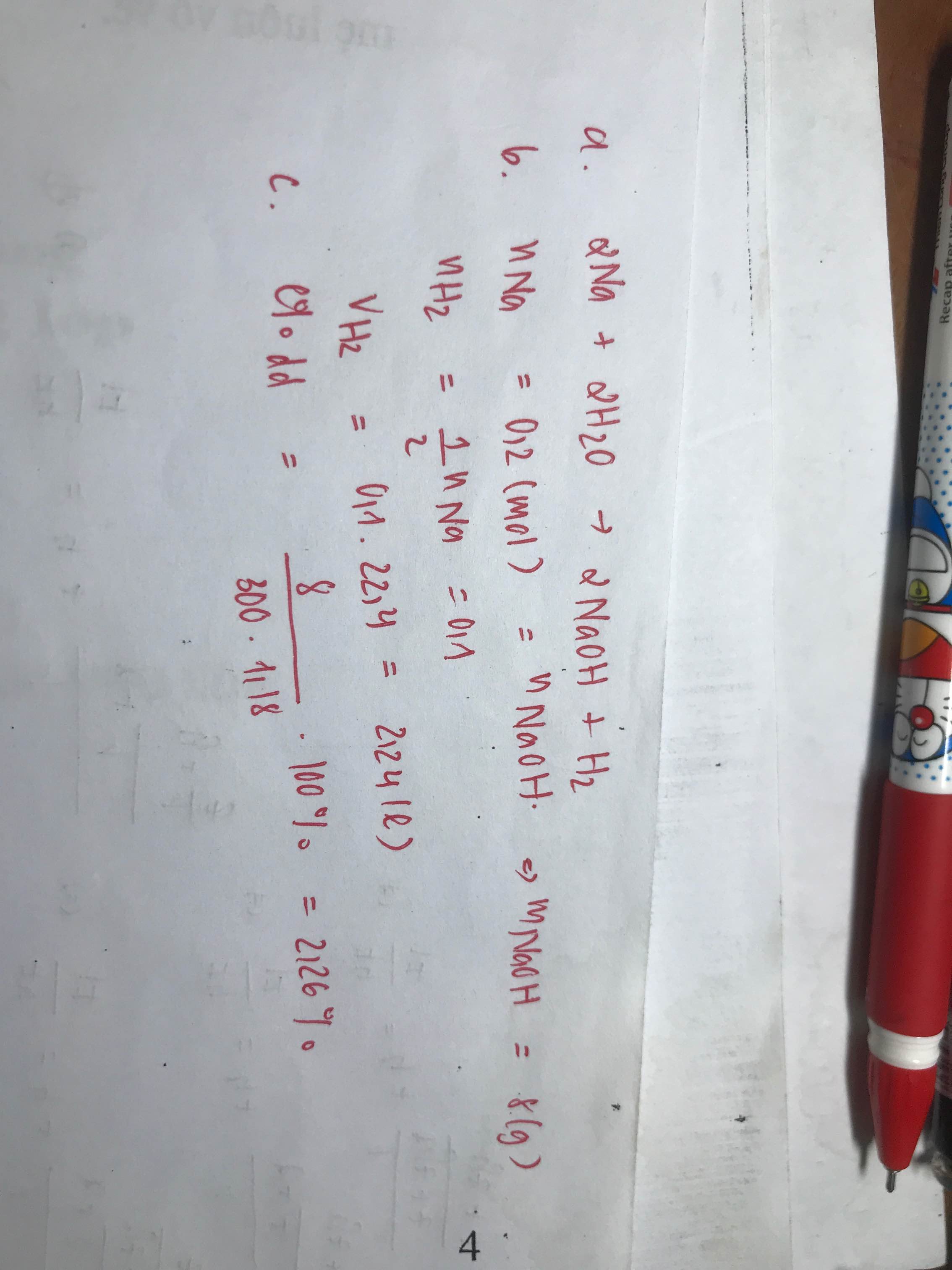
Đốt cháy hoàn toàn 4,6g Natri rồi lấy sản phẩm cho vào 120g dd NaOH 25% thu được dd X. Tính C% dd X
--
nNa= 0,2(mol)
mNaOH= 120.25%= 30(g) -> nNaOH= 0,75(mol)
PTHH: Na + H2O -> NaOH +1/2 H2 (1)
nNaOH (1)= nNa= 0,2(mol)
=> nNaOH= 0,2+0,75=0,95(mol)
mNaOH= 0,95.40= 38(g)
mddNaOH(sau)= 120+4,6-0,1.2= 124,4(g)
=> \(C\%ddNaOH\left(sau\right)=\frac{38}{124,4}.100\approx30,547\%\)
Cô ơi , em nghĩ khối lượng dung dịch sau phản ứng là tổng khối lượng Na2O thêm vào và dd NaOH ban đầu chứ ạ :<<