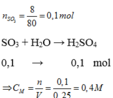Trộn 1 mol H2O với 1 mol H2SO4. Dung dịch axit thu được có nồng độ
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Nồng độ mol của dung dịch H 2 SO 4 :
n H 2 SO 4 = n SO 3 = 8/80 = 0,1 mol
Theo phương trình hoá học :
C Mdd H 2 SO 4 = 1000x0,1/250 = 0,4M

30ml = 0,03l
70ml = 0,07l
\(n_{H2SO4}=1.0,03=0,03\left(mol\right)\)
\(n_{BaCl2}=1.0,07=0,07\left(mol\right)\)
Pt : \(BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl|\)
1 1 1 2
0,07 0,03 0,06
Lập tỉ số so sánh : \(\dfrac{0,07}{1}>\dfrac{0,03}{1}\)
⇒ BaCl2 dư , H2SO4 phản ứng hết
⇒ Tính toán dựa vào số mol của H2SO4
\(n_{HCl}=\dfrac{0,03.2}{1}=0,06\left(mol\right)\)
\(V_{ddspu}=0,03+0,07=0,1\left(l\right)\)
\(C_{M_{ddHCl}}=\dfrac{0,06}{0,1}=0,6\left(M\right)\)
⇒ Chọn câu : B
Chúc bạn học tốt
\(nH_2SO_4=\dfrac{30}{1000}.1=0,03mol\)
\(V_{ddH_2SO_4}=\dfrac{30}{1000}=0,03lit\)
\(C_{MH_2SO_4}=\dfrac{0,03}{0,03}=1M\)
=> tất cả đều sai

Gọi a, b là CM của H2SO4, NaOH.
+ TN1: NaOH pứ hết, H2SO4 dư
nH2SO4 = 0.12a => nH+ = 0.24a
nNaOH = 0.04b => nOH- = 0.04b
nH2SO4 dư = 0.1*(0.12 + 0.04) = 0.016 => nH+ dư = 0.032
2H+ ... +.... OH- + SO4(2-) -----> HSO4- + H2O
0.08b.........0.04b
nH+ dư = 0.24a - 0.08b = 0.032 (1)
+ TN2: H2SO4 pứ hết, NaOH dư
nH2SO4 = 0.04a => nH+ = 0.08a
nNaOH = 0.06b => nOH- = 0.06b
nNaOH dư = 0.16*(0.04 + 0.06) = 0.016 => nOH- dư = 0.016
H+ + OH- ------> H2O
0.08a....0.08a
=> nOH- dư = 0.06b - 0.08a = 0.016 (2)
Từ (1) và (2) => a = 0.4, b = 0.8

\(V_{\text{dd}}=200+250=450ml=0,45l\\ n_{H_2SO_4}=\left(0,2.1\right)+\left(2.0,25\right)=0,7\left(mol\right)\\ C_M=\dfrac{0,7}{0,45}=1,5M\)

\(n_{NaOH}=0.25\cdot2=0.5\left(mol\right)\)
\(n_{H_2SO_4}=0.25\cdot1=0.25\left(mol\right)\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+H_2O\)
\(0.5..............0.25................0.25\)
\(\left[Na^+\right]=\dfrac{0.25\cdot2}{0.25+0.25}=1\left(M\right)\)
\(\left[SO_4^{2-}\right]=\dfrac{0.25}{0.25+0.25}=0.5\left(M\right)\)