2.Cho 31,4 g hỗn hợp các kim loại Zn và Al tác dụng với 200 ml dung dịch H2 SO4 khi phản ứng kết thúc thu được 15,68 lít khí H2(đktc).Tính khối lượng muối thu được và nồng độ mol H2 SO4 cần dùng?
MỌI NGƯỜI GIÚP MÌNH VỚI MÌNH CẢM ƠN
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1.Cho 6,8 g hỗn hợp các kim loại Mg và Fe tác dụng với dung dịch H2SO4 1,5M khi phản ứng kết thúc thu được 3.36 lít khí H2(đktc).Tính khối lượng muối thu được và thể tích dung dịch H2SO4 cần dùng?
nH2 = nSO4 = 3,36/22,4 = 0,15(mol)
mmuối = mkl + mSO4 = 6,8 + 0,15.96=21,2(g)
VH2SO4=0,15/1,5=0,1(l) = 100 (ml)
2.Cho 3,14 g hỗn hợp các kim loại Zn và Al tác dụng với 200 ml dung dịch H2SO4 khi phản ứng kết thúc thu được 15,68 lít khí H2(đktc).Tính khối lượng muối thu được và nồng độ mol H2SO4 cần dùng?
nH2 = nSO4 = 15,68/22,4 = 0,7(mol)
mmuối = mkl + mSO4 = 3,14 + 0,7.96= 70,34(g)
CMH2SO4=0,7/0,2=3,5M
4.Cho 36g hỗn hợp X chứa Fe2O3 và CuO tác dụng vừa đủ với 500 ml dung dịch H2SO4 thu được 80 gam hỗn hợp muối.
a.Tính phần trăm khối lượng từng chất trong hỗn hợp X .
b.Tính nồng độ mol dung dịch H2SO4 cần dùng.
gọi x, y lần lượt là số mol của Fe2O3 và CuO
=> 160x + 80y =36(g)...................(1)
hỗn hợp muối chứa 2 muối là: Fe2(SO4)3 và CuSO4
=> 400x + 160y = 80(g) ....................(2)
từ (1) và (2)=> hệ\(\left\{{}\begin{matrix}160x+80y=36\\400x+160y=80\end{matrix}\right.\)
giải hệ ta được:
\(\left\{{}\begin{matrix}x=0,1\\y=0,25\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}m_{Fe2O3}=0,1.160=16\left(g\right)\\m_{CuO}=0,25.80=20\left(g\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}\%m_{Fe2O3}=\frac{16}{36}.100\%=44,44\%\\\%m_{CuO}=100\%-44,44\%=55,56\%\end{matrix}\right.\)
nSO4 = nH2SO4 = 0,1.3/2 + 0,25=0,4(mol)
=>CMH2SO4=0,4/0,5=0,8M

Đáp án A
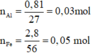
Sau phản ứng thu được 3 kim loại => Fe còn dư; Al, AgNO3 và Cu(NO3)2 đều phản ứng hết; 3 kim loại thu được gồm Ag, Cu và Fe dư.
![]()
Đặt số mol của AgNO3 và Cu(NO3)2 lần lượt là a, b
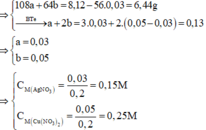

a, \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(m_{HCl}=730.10\%=73\left(g\right)\Rightarrow n_{HCl}=\dfrac{73}{36,5}=2\left(mol\right)\)
\(n_{H_2}=\dfrac{17,92}{22,4}=0,8\left(mol\right)\)
→ nHCl > 2nH2 ⇒ HCl dư.
Ta có: 27nAl + 65nZn = 23,8 (1)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}+n_{Zn}=0,8\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Al}=0,4\left(mol\right)\\n_{Zn}=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,4.27}{23,8}.100\%\approx45,4\%\\\%m_{Zn}\approx54,6\%\end{matrix}\right.\)
b, Theo PT: \(\left\{{}\begin{matrix}n_{AlCl_3}=n_{Al}=0,4\left(mol\right)\\n_{ZnCl_2}=n_{Zn}=0,2\left(mol\right)\\n_{HCl\left(pư\right)}=2n_{H_2}=1,6\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{HCl\left(dư\right)}=2-1,6=0,4\left(mol\right)\)
Ta có: m dd sau pư = 23,8 + 730 - 0,8.2 = 752,2 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{AlCl_3}=\dfrac{0,4.133,5}{752,2}.100\%\approx7,1\%\\C\%_{ZnCl_2}=\dfrac{0,2.136}{752,2}.100\%\approx3,62\%\\C\%_{HCl}=\dfrac{0,4.36,5}{752,2}.100\%\approx1,94\%\end{matrix}\right.\)

\(n_{H_2\left(dktc\right)}=\dfrac{V}{22,4}=\dfrac{1,792}{22,4}=0,08\left(mol\right)\)
đặt \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\)
\(PTHH:Zn+H_2SO_4->ZnSO_4+H_2\)
tỉ lệ 1 : 1 : 1 : 1
n(mol) a---->a------------>a---------->a (1)
\(PTHH:2Al+3H_2SO_4->Al_2\left(SO_4\right)_3+3H_2\)
tỉ lệ 2 : 3 ; 1 : 3
n(mol) b-------->3/2b----->1/2b------------>3/2b (2)
Từ (1) và (2) ta có
\(\left\{{}\begin{matrix}65a+27b=3,79\\a+\dfrac{3}{2}b=0,08\end{matrix}\right.=>\left\{{}\begin{matrix}a=0,05\left(mol\right)\\b=0,02\left(mol\right)\end{matrix}\right.\)
\(=>\left\{{}\begin{matrix}m_{Zn}=n\cdot M=0,05\cdot65=3,25\left(g\right)\\m_{Al}=n\cdot M=0,02\cdot27=0,54\left(g\right)\end{matrix}\right.\)
\(=>\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{3,25\cdot100\%}{3,79}\approx85,75\%\\\%m_{Al}=100\%-85,75\approx14,25\%\end{matrix}\right.\)
với (1) thì
\(n_{H_2SO_4\left(1\right)}=a=0,05\left(mol\right)\)
với (2) thì
\(n_{H_2SO_4\left(2\right)}=\dfrac{3}{2}b=\dfrac{3}{2}\cdot0,02=0,03\left(mol\right)\)
\(=>m_{H_2SO_4}=\left(0,05+0,03\right)\cdot98=7,84\left(g\right)\)

\(n_{H_2}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
PTHH: 2R + 3H2SO4 --> R2(SO4)3 + 3H2
____0,04<----0,06-------0,02<------0,06____(mol)
=> \(M_R=\dfrac{1,08}{0,04}=27\left(g/mol\right)=>Al\)
\(C_{M\left(H_2SO_4\right)}=\dfrac{0,06}{0,05}=1,2M\)

Ta có: \(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
____0,1______0,2_____0,1____0,1 (mol)
a, \(C_{M_{HCl}}=\dfrac{0,2}{0,15}=\dfrac{4}{3}\left(M\right)\)
\(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
b, \(FeCl_2+2NaOH\rightarrow2NaCl+Fe\left(OH\right)_2\)
Theo PT: \(n_{NaOH}=2n_{FeCl_2}=0,2\left(mol\right)\)
\(\Rightarrow V_{NaOH}=\dfrac{0,2}{2}=0,1\left(l\right)\)

\(Zn+2HCl->ZnCl_2+H_2\\ m_{Zn}=\dfrac{7,437}{24,79}\cdot65=19,5g\\ m_{HCl}=\dfrac{7,437}{24,79}\cdot2\cdot36,5=21,9g\)
Gọi \(\left\{{}\begin{matrix}n_{Al}:x\left(mol\right)\\n_{Zn}:y\left(mol\right)\end{matrix}\right.\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(2Al+6H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
Giải hệ PT:
\(\left\{{}\begin{matrix}27x+65y=31,4\\1,5x+y=0,7\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,4\end{matrix}\right.\)
\(\left\{{}\begin{matrix}n_{Al2\left(SO4\right)3}=\frac{0,2}{2}=0,1\left(mol\right)\\n_{ZnSO4}=n_{Zn}=0,4\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Al2\left(SO4\right)3}=0,1.342=34,2\left(g\right)\\m_{ZnSO4}=0,4.161=64,4\left(g\right)\end{matrix}\right.\)
\(\Rightarrow n_{H2SO4}=n_{H2}=0,7\left(mol\right)\)
\(\Rightarrow CM_{H2SO4}=\frac{0,7}{0,2}=3,5M\)