Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1.Cho 6,8 g hỗn hợp các kim loại Mg và Fe tác dụng với dung dịch H2SO4 1,5M khi phản ứng kết thúc thu được 3.36 lít khí H2(đktc).Tính khối lượng muối thu được và thể tích dung dịch H2SO4 cần dùng?
nH2 = nSO4 = 3,36/22,4 = 0,15(mol)
mmuối = mkl + mSO4 = 6,8 + 0,15.96=21,2(g)
VH2SO4=0,15/1,5=0,1(l) = 100 (ml)
2.Cho 3,14 g hỗn hợp các kim loại Zn và Al tác dụng với 200 ml dung dịch H2SO4 khi phản ứng kết thúc thu được 15,68 lít khí H2(đktc).Tính khối lượng muối thu được và nồng độ mol H2SO4 cần dùng?
nH2 = nSO4 = 15,68/22,4 = 0,7(mol)
mmuối = mkl + mSO4 = 3,14 + 0,7.96= 70,34(g)
CMH2SO4=0,7/0,2=3,5M
4.Cho 36g hỗn hợp X chứa Fe2O3 và CuO tác dụng vừa đủ với 500 ml dung dịch H2SO4 thu được 80 gam hỗn hợp muối.
a.Tính phần trăm khối lượng từng chất trong hỗn hợp X .
b.Tính nồng độ mol dung dịch H2SO4 cần dùng.
gọi x, y lần lượt là số mol của Fe2O3 và CuO
=> 160x + 80y =36(g)...................(1)
hỗn hợp muối chứa 2 muối là: Fe2(SO4)3 và CuSO4
=> 400x + 160y = 80(g) ....................(2)
từ (1) và (2)=> hệ\(\left\{{}\begin{matrix}160x+80y=36\\400x+160y=80\end{matrix}\right.\)
giải hệ ta được:
\(\left\{{}\begin{matrix}x=0,1\\y=0,25\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}m_{Fe2O3}=0,1.160=16\left(g\right)\\m_{CuO}=0,25.80=20\left(g\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}\%m_{Fe2O3}=\frac{16}{36}.100\%=44,44\%\\\%m_{CuO}=100\%-44,44\%=55,56\%\end{matrix}\right.\)
nSO4 = nH2SO4 = 0,1.3/2 + 0,25=0,4(mol)
=>CMH2SO4=0,4/0,5=0,8M

Bài 1:
\(n_{HCl}=2.0,16=0,32\left(mol\right);n_{H_2}=\dfrac{3,584}{22,4}=0,16\left(mol\right)\)
PTHH: Mg + 2HCl → MgCl2 + H2
PTHH: Fe + 2HCl → FeCl2 + H2
\(m_{H_2}=0,16.2=0,32\left(g\right)\)
\(m_{HCl}=0,32.36,5=11,68\left(g\right)\)
Theo ĐLBTKL ta có: \(m_{MgCl_2+FeCl_2}=1,4+11,68-0,32=12,76\left(g\right)\)
Bài 12:
Theo ĐLBTKL, ta có:
\(m_{hhkl}+m_{O_2}=m_{hh.oxit}\\ \Leftrightarrow11,9+m_{O_2}=18,3\\ \Leftrightarrow m_{O_2}=18,3-11,9=6,4\left(g\right)\\ n_{O_2}=\dfrac{6,4}{32}=0,2\left(mol\right)\\ V_{O_2\left(đktc\right)}=0,2.22,4=4,48\left(l\right)\)

a) Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Zn}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow56a+65b=12,1\) (1)
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Bảo toàn electron: \(2n_{Fe}+2n_{Zn}=2n_{H_2}\) \(\Rightarrow2a+2b=0,4\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,1\cdot56}{12,1}\cdot100\%\approx46,28\%\\\%m_{Zn}=53,72\%\end{matrix}\right.\)
b)
Bảo toàn nguyên tố: \(\left\{{}\begin{matrix}n_{FeSO_4}=n_{Fe}=n_{Zn}=n_{ZnSO_4}=0,1\left(mol\right)\\n_{H_2SO_4\left(p.ứ\right)}=n_{H_2}=0,2\left(mol\right)\Rightarrow\Sigma n_{H_2SO_4}=0,2\cdot110\%=0,22\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{FeSO_4}=0,1\cdot152=15,2\left(g\right)\\m_{ZnSO_4}=0,1\cdot161=16,1\left(g\right)\\m_{H_2}=0,2\cdot2=0,4\left(g\right)\\m_{H_2SO_4\left(dư\right)}=\left(0,22-0,2\right)\cdot98=1,96\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd}=m_{KL}+m_{ddH_2SO_4}-m_{H_2}=211,7\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{FeSO_4}=\dfrac{15,2}{211,7}\cdot100\%\approx7,18\%\\C\%_{ZnSO_4}=\dfrac{16,1}{211,7}\cdot100\%\approx7,61\%\\C\%_{H_2SO_4}=\dfrac{1,96}{22,4}\cdot100\%\approx0,93\%\end{matrix}\right.\)

a) Ta có: \(n_{H_2}=\dfrac{15,68}{22,4}=0,7\left(mol\right)\)
Gọi a và b lần lượt là số mol của Al và Zn
Bảo toàn mol e: \(3a+2b=1,4\)
Mà \(27a+65b=31,4\)
\(\Rightarrow\left\{{}\begin{matrix}a=0,2\\b=0,4\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,2\cdot27}{31,4}\cdot100\%\approx17,2\%\\\%m_{Zn}=82,8\%\end{matrix}\right.\)
b) Bảo toàn nguyên tố: \(n_{HCl}=2n_{H_2}=1,4mol\)
\(\Rightarrow V_{HCl}=\dfrac{1,4}{2}=0,7\left(l\right)=700\left(ml\right)\)
Đặt :
nAl = a mol
nZn = b mol
mB = 27a + 65b = 31.4 (g) (1)
2Al + 6HCl => 2AlCl3 + 3H2
a___________________1.5a
Zn + 2HCl => ZnCl2 + H2
b__________________b
nH2 = 1.5a + b = 15.68/22.4 = 0.7 (mol) (2)
(1) , (2) :
a = 0.2
b = 0.4
%Al = 5.4/31.4 * 100% = 17.19%
%Zn = 100 - 17.19 = 82.81%
nHCl = 2nH2 = 0.7*2 = 1.4 (mol)
Vdd HCl = 1.4 / 2 = 0.7 (l)

Đáp án D
Nhận thấy ở hai thí nghiệm có lượng kim loại tham gia phản ứng như nhau, lượng HCl sử dụng lớn hơn lượng HCl sử dụng ở thí nghiệm 1 nhưng lượng H2 ở hai thí nghiệm thu được như nhau.
Do đó ở thí nghiệm 2 HCl phản ứng dư, thí nghiệm 1 có HCl phản ứng đủ hoặc dư.
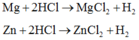
Có
![]()
Quan sát 4 đáp án nhận thấy chỉ có giá trị 0,3 là phù hợp.

a)\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Mol: x 1,5x
PTHH: Mg + H2SO4 → MgSO4 + H2
Mol: y y
Ta có: \(\left\{{}\begin{matrix}27x+24y=5,1\\1,5x+y=0,25\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
\(\%m_{Al}=\dfrac{0,1.27.100\%}{5,1}=52,94\%;\%m_{Mg}=100-52,94=47,06\%\)
b)
PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Mol: 0,1 0,15 0,05
PTHH: Mg + H2SO4 → MgSO4 + H2
Mol: 0,1 0,1 0,1
\(m_{ddH_2SO_4}=\dfrac{\left(0,1+0,15\right).98.100}{9,8}=250\left(g\right)\)
mdd sau pứ = 5,1+250-0,15.2 = 254,8(g)
\(C\%_{ddAl_2\left(SO_4\right)_3}=\dfrac{0,05.342.100\%}{254,8}=6,71\%\)
\(C\%_{ddMgSO_4}=\dfrac{0,1.120.100\%}{254,8}=4,71\%\)


Gọi \(\left\{{}\begin{matrix}n_{Al}:x\left(mol\right)\\n_{Zn}:y\left(mol\right)\end{matrix}\right.\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(2Al+6H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
Giải hệ PT:
\(\left\{{}\begin{matrix}27x+65y=31,4\\1,5x+y=0,7\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,4\end{matrix}\right.\)
\(\left\{{}\begin{matrix}n_{Al2\left(SO4\right)3}=\frac{0,2}{2}=0,1\left(mol\right)\\n_{ZnSO4}=n_{Zn}=0,4\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Al2\left(SO4\right)3}=0,1.342=34,2\left(g\right)\\m_{ZnSO4}=0,4.161=64,4\left(g\right)\end{matrix}\right.\)
\(\Rightarrow n_{H2SO4}=n_{H2}=0,7\left(mol\right)\)
\(\Rightarrow CM_{H2SO4}=\frac{0,7}{0,2}=3,5M\)