Bài 1: Cho 1 oxit kim loại hóa trị I. Nếu cho 3g oxit này + nước dư thu được dd A có tính kiềm. Chia A làm 2 phần bằng nhau.
Phần 1: Cho td với 90ml dd HCl 1M thấy dd sau PƯ làm xanh quỳ tím
Phần 2: Cho td với V(ml) dd HCl 1M thấy dd sau PƯ ko làm quỳ tím đổi màu
a) Tìm CT của oxit
b) Tính V=? ml
Bài 2: Cho 9,33g 1 khối lượng X + 5,6l Cl2(đktc) thu được muối A, tan A trong 520ml dd NaOH thu được kết tủa B và dd C, trung hòa dd C cần 100ml dd ACl 0,2M.
a) Xác định kim loại X
b) CM dd NaOH
c) mNaCl=?
Giúp mk nhoa. Ai lop du chu ca mo >3<

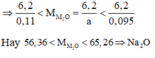
Câu 1:
Gọi kim loại là R suy ra oxit là R2O
\(R_2O+H_2O\rightarrow2ROH\)
Ta có:
\(n_{R2O}=\frac{3}{2R+16}\Rightarrow n_{ROH}=2n_{R2O}=\frac{3}{R+8}\)
Chia hỗn hợp A thành 2 phần bằng nhau.
Phần 1 tác dụng với 0,09 mol HCl thì dung dịch làm xanh quỳ tím, do vậy ROH dư.
\(ROH+HCl\rightarrow RCl+H_2O\)
\(\frac{1}{2}.\frac{3}{R+8}< 0,09\Rightarrow\frac{3}{2R+16}>0,09\)
\(\Rightarrow2R+16< \frac{3}{0,09}\Rightarrow R< 8,67\)
\(\Leftrightarrow R=7\left(Li\right)\)
Vậy oxit là Li2O
Trong mỗi phần
\(n_{LiOH}=\frac{3}{2R+16}=0,1\left(mol\right)\)
\(\Rightarrow n_{HCl}=n_{LiOH}=0,1\left(mol\right)\)
\(\Rightarrow V_{HCl}=\frac{0,1}{1}=0,1\left(l\right)=100\left(ml\right)\)
Câu 2:
Xem lại đề