Hỗn hợp X gồm Cu, Al, Fe. Cho 57,2 gam X tác dụng với dung dịch HCl dư, sauphản ứng hoàn toàn thoát ra 26,88 lít H2 (đktc). Ở nhiết độ cao 1,2 mol X tác dụng vừa đủ với 89,6lít không khí trong đó 1/5 là oxi còn lại là ni tơ (đktc). a) Viết phương trình hóa học của các phản ứng.b) Tính % khối lượng của các chất trong X
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : A
Trong 53,75g X có x mol Sn ; y mol Fe ; z mol Al
=> t(119x + 56y + 27z) = 53,75g
X + Cl2 -> SnCl4 ; FeCl3 ; AlCl3
⇒ t 4 x + 3 y + 3 z = 2 n C l 2 = 2 , 25 m o l
(Trong 0,4 mol lượng chất gấp t lần)
=> 9(119x + 56y + 27z) = 215(4x + 3y + 3z)
=> 211x – 141y – 402z = 0(1)
=> x + y + z = 0,4 mol(2)
n H 2 = x + y + 1,5z = 31/70 (mol) (3)
Từ (1,2,3) => z = 0,0857 mol
=> mAl = 2,314g

Gọi a,b,c lần lượt là số mol của Cu Fe Al
=> 64a + 56b + 27c = 57,2 (I)
PTHH
Fe + 2HCl ----> FeCl2 + H2
.b......2b..............b..........b..(mol)
2Al + 6HCl ----> 2AlCl3 + 3H2
..c.....3c................c..........1,5c
b+1,5c=26,8822,4=1,2b+1,5c=26,8822,4=1,2(II)
2Cu + O2 --to--> 2CuO
..a......0,5a
3Fe + 2O2 --to--> Fe3O4
..b....(2/3)b..
4Al + 3O2 --to--> 2Al2O3
c......0,75c....
=>0,5a+23b+0,75c=25,632=0,80,5a+23b+0,75c=25,632=0,8(III)
Từ (I) (II) và (III)
=>{a=0,2,b=0,6:c=0,4
Phần sau tự giải nhé

\(n_{Cu} = a ; n_{Al} = b ; n_{Fe} = c(mol)\\ \Rightarrow 64a + 27b + 56c = 28,6(1)\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\\ Fe + 2HCl \to FeCl_2 + H_2\\ n_{H_2} = 1,5b + c = \dfrac{13,44}{22,4} = 0,6(2)\\ \text{Mặt khác} : n_{O_2} = \dfrac{8,96}{22,4} = 0,4(mol)\\ 2Cu + O_2 \xrightarrow{t^o} 2CuO\\ 4Al + 3O_2 \xrightarrow{t^o} 2Al_2O_3\\ 4Fe + 3O_2 \xrightarrow{t^o} 2Fe_2O_3\\ \)
Ta có :
\(\dfrac{n_X}{n_{O_2}}=\dfrac{a+b+c}{0,5a +0,75b + 0,75c} = \dfrac{0,6}{0,4}(3)\\ (1)(2)(3)\Rightarrow a = \dfrac{317}{1460} ; b = \dfrac{121}{365}; c = \dfrac{15}{146}\\ \%m_{Cu} = \dfrac{\dfrac{317}{1460}.64}{28,6}.100\% = 48,59\%\\ \%m_{Al} = \dfrac{\dfrac{121}{365}.27}{28,6}.100\% = 31,3\%\\ \%m_{Fe} = 100\% - 41,59\% - 31,3\% = 27,11\%\)

\(n_{Cl_2}=\dfrac{13.44}{22.4}=0.6\left(mol\right)\)
\(n_{H_2}=\dfrac{11.2}{22.4}=0.5\left(mol\right)\)
\(n_{Fe}=a\left(mol\right),n_{Al}=b\left(mol\right)\)
\(n_{H_2}=a+1.5b=0.5\left(mol\right)\)
\(n_{Cl_2}=1.5a+1.5b=0.6\left(mol\right)\)
\(\Rightarrow a=b=0.2\)
\(m_X=0.2\cdot\left(56+27\right)=16.6\left(g\right)\)

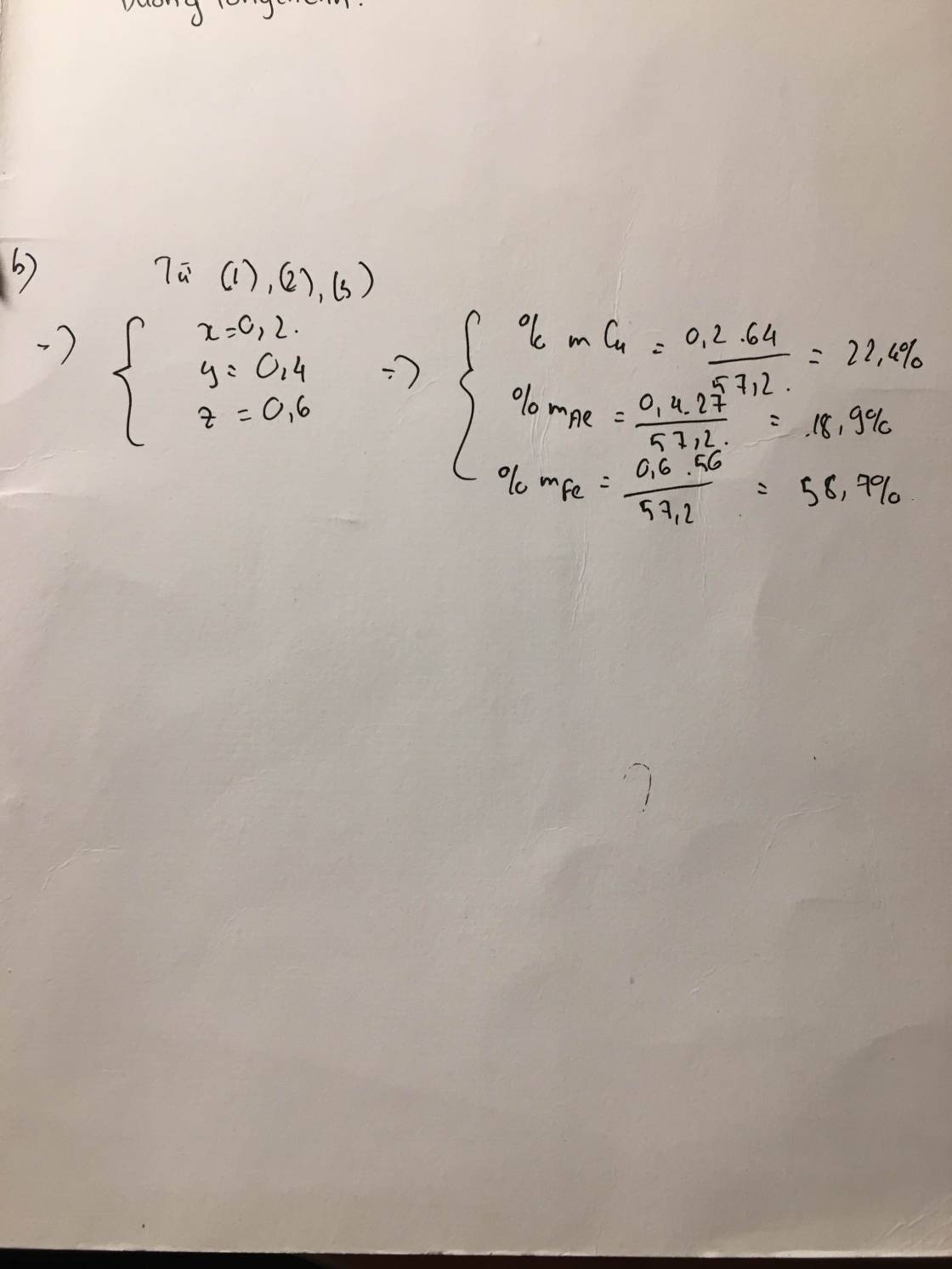

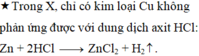


cho e hỏi chút tại sao : 1,2 mol X chứa k x mol Cu; ky mol Al và kz mol Fe vậy ạ
Bạn đặt nhé