Đốt cháy hoàn toàn 8,96 lit H2S (đktc) rồi hoà tan tất cả sản phẩm sinh ra vào 80 ml dung dịch NaOH 25% ( d= 1,28 g/ml). Tính nồng độ phần trăm của các chất trong dung dịch thu được?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{H_2S}=\dfrac{8.96}{22.4}=0.4\left(mol\right)\)
\(H_2S+\dfrac{3}{2}O_2\underrightarrow{^{^{t^0}}}SO_2+H_2O\)
\(0.4.................0.4\)
\(n_{NaOH}=n_{SO_2}=0.4\left(mol\right)\)
=> Tạo muối axit
\(NaOH+SO_2\rightarrow NaHSO_3\)
\(0.4............................0.4\)
\(m_{NaHSO_3}=0.4\cdot104=41.6\left(g\right)\)

PT: \(2Al+3Cl_2\underrightarrow{t^o}2AlCl_3\)
\(AlCl_3+3AgNO_3\rightarrow Al\left(NO_3\right)_3+3AgCl\)
Ta có: \(n_{AgNO_3}=0,1.0,6=0,06\left(mol\right)\)
Theo PT: \(n_{Al}=n_{AlCl_3}=\dfrac{1}{3}n_{AgNO_3}=0,02\left(mol\right)\)
⇒ m = mAl = 0,02.27 = 0,54 (g)
\(C_{M_{AlCl_3}}=\dfrac{0,02}{0,15}=\dfrac{2}{15}\left(M\right)\)

\(BTNT\left(S\right):n_{SO3}=n_{SO2}=\dfrac{V}{22,4}=\dfrac{5}{14}\left(mol\right)\)
Ta có : \(n_{H2SO4}=\dfrac{9}{25}\left(mol\right)\)
\(\Rightarrow\Sigma n_{H2SO4}=\dfrac{5}{14}+\dfrac{9}{25}=\dfrac{251}{350}\left(mol\right)\)
\(\Rightarrow C\%=\dfrac{m_{H2SO4}}{m_{dd}}.100\%=64,7\%\)

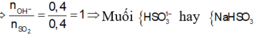

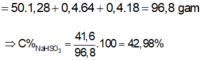


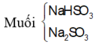

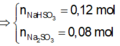
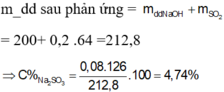

Không hiện gì lên đâu :)
buithianhtho what ? có mà