1 hỗn hợp gồm 2 oxit là CuO và Fe2O3 đem khử bằng H2 thu được 28,8g chất rắn và 12.6g H2O. Tính khối lượng của 2 oxit
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) Đặt nMgO=a;nFe2O3=b(mol) (a,b>0)
=> 40a+160b=32 (1)
PTHH:
Fe2O3+3H2----->2Fe+3H2O (*)
b 3b 2b 3b (mol)
Từ PTHH (*) => nFe=2b (mol)
Do MgO không phản ứng với H2 nên chất rắn X gồm: MgO,Fe.
=> 40a+56.2b=24,8 (2)
Từ (1) và (2) => \(\hept{\begin{cases}a=0,2\\b=0,15\end{cases}}\)
=> \(\hept{\begin{cases}mMgO=0,2.40=8\left(g\right)\\mFe2O3=0,15.160=24\left(g\right)\end{cases}}\)
=> \(\hept{\begin{cases}\%mMgO=25\%\\\%mFe2O3=75\%\end{cases}}\)
b) Từ PTHH (*) => nFe= 2.0,2=0,4 (mol)
PTHH:
MgO+2HCl----->MgCl2+H2O
0,2 0,4 0,2 0,2 (mol)
Fe+2HCl----->FeCl2+H2
0,4 0,8 0,4 0,4 (mol)
Từ PTHH => nHCl=1,2 (mol); nH2=0,4 (mol)
=> \(V_{ddHCl}=\frac{1,2}{2}=0,6\left(l\right);V_{H2}=0,4.22,4=8,96\left(l\right)\)
CHÚC BẠN HỌC TỐT !!!

\(\left\{{}\begin{matrix}CuO:a\\Fe2O3:2a\end{matrix}\right.\)
a.\(80a+320a=24\Leftrightarrow a=0.06\)
\(\Rightarrow\left\{{}\begin{matrix}CuO=0.06\\Fe2O3=0.12\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}CuO=4.8g\\Fe2O3=19.2g\end{matrix}\right.\)
b.\(CuO+H2\rightarrow Cu+H2O\)
a a a
\(Fe2O3+3H2\rightarrow2Fe+3H2O\)
2a 6a 4a
\(\Rightarrow V_{H2}=\left(a+6a\right)\times22.4=9.408l\)
c.nHCl = 0.2 mol
\(Fe+2HCl\rightarrow FeCl2+H2\)
0.1 0.2
m chất rắn còn lại = mCu + m Fe ban đầu - m Fe bị hòa tan
= \(a\times64+4a\times56-0.1\times56=11.68g\)

Đáp án A
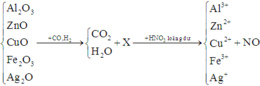
Trong toàn bộ quá trình, chỉ có nguyên tử C trong CO, H trong H2 và N trong HNO3 có sự thay đổi số oxi hóa.
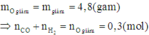
Áp dụng định luật bảo toàn mol electron, ta có:
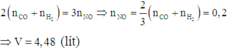

khử 2,4 g hỗn hợp gồm CuO và Fe2O3 bằng H2 ở nhiệt độ cao thì thu được 1,76g hỗn hợp 2 kim loại đem hỗn hợp 2 kim loại hòa tan bằng dd axit HCl thì thu được V(lít) khí H2 a) xác định % về khối lượng của mỗi oxit trong hỗn hợp b) tính v (ở đktc)
\(CuO +H2 ---> Cu + H2O\) \(Fe2O3 + 3H2 --> 2Fe +3H2O\) Đặt a là nCuO, b là nFe2O3 Theo đề, ta có hệ phương trình: \(<=> \) \(\begin{cases} 80a + 160b = 2,4 \\64a + 112b = 1,76 \end{cases}\) \(<=> \) \(\begin{cases} a = 0,01 \\ b = 0,01 \end{cases}\) => mCuO = 0,01.80 = 0,8 (g) mFe2O3 = 2,4 - 0,8 = 1,6 (g) %mCuO = \(\frac{0,8.100}{2,4}\) = 33,33% => %mFe2O3 = 100% - 33,33% = 66,67% \(b)\) \(%mCuO = (0,8.100)/2,4\)\(Cu + 2HCl --> CuCl2 + H2\) \(Fe + 2HCl --> FeCl2 + H2\) \(nCu = a = 0,01 (mol)\) \(nFe = 2b = 0,02 (mol)\) Theo phương trinh hóa học \(nH2 = 0,03 (mol)\) \(=>\)\(V_H2\) = \(0,03.22,4 = 0,672 (l)\)
a/ \(CuO\left(x\right)+H_2\left(x\right)\rightarrow Cu\left(x\right)+H_2O\)
\(Fe_2O_3\left(y\right)+3H_2\left(3y\right)\rightarrow2Fe\left(2y\right)+3H_2O\)
Gọi số mol của CuO và Fe2O3 lần lược là x, y. Ta có hệ:
\(\left\{\begin{matrix}80x+160y=2,4\\64x+2y.56=1,76\end{matrix}\right.\)
\(\Leftrightarrow\left\{\begin{matrix}x=0,01\\y=0,01\end{matrix}\right.\)
\(\Rightarrow m_{CuO}=0,01.80=0,8\left(g\right)\)
\(\Rightarrow m_{Fe_2O_3}=0,01.160=1,6\left(g\right)\)
\(\Rightarrow\%CuO=\frac{0,8}{2,4}.100\%=33,33\%\)
\(\Rightarrow\%Fe_2O_3=100\%-33,33\%=66,67\%\)
b/ \(V=0,03.22,4=0,672\left(l\right)\)

CuO +H2 --> Cu +H2O(1)
PbO +H2 --> Pb +H2O(2)
a) giả sử nCuO=x(mol)
nPbO=y(mol)
=> 80x+ 223y=5,43 (I)
theo (1) : nH2O=nCuO=x(mol)
theo (2) : nH2O=nPbO=y(mol)
=> 18x+18y=0,9(II)
từ (I) và (II) ta có :
80x + 223y=5,43
18x+18y=0,9
=>x=0,04(mol) , y=0,01(mol)
=>mCuO=0,04 .80=3,2(g)
mPbO=0,01 .223=2,23(g)
=> %mCuO=3,2/5,43 .100=58,93(%)
%mPbO=100 -58,93=41,07(%)
b) theo (1)(2) : nH2=nH2O=0,9/18=0,05(mol)
=> mH2=0,1(g)
ADĐLBTKL ta có :
mhh sau phản ứng=5,43+0,1 -0,9=4,63(g)
theo (1) :nCu=nCuO=0,04(mol)
=> %mCu=0,04 .64/4,63 .100=55,29(%)
%mPbO=100 -55,29=44,71(%)

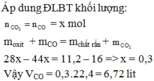
Gọi x, y lần lượt là số mol của CuO và Fe2O3
PTHH:
CuO + H2 ---to---> Cu + H2O (1)
Fe2O3 + 3H2 ---to---> 2Fe + 3H2O (2)
Theo PT(1): \(n_{Cu}=n_{CuO}=x\left(mol\right)\)
Theo PT(2): \(n_{Fe}=2.n_{Fe_2O_3}=2y\left(mol\right)\)
=> 64x + 320y = 28,8 (*)
Theo PT(1): \(n_{H_2O}=n_{CuO}=x\left(mol\right)\)
Theo PT(2): \(n_{H_2O}=3.n_{Fe_2O_3}=3y\left(mol\right)\)
=> 18x + 54y = 12,6 (**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}64x+320y=28,8\\18x+54y=12,6\end{matrix}\right.\)
(Ra số âm, bn xem lại đề nhé.)
bạn sai hpt rồi nhé :))