Cho 4,35 gam MnO2 vào 300 ml dd HCl 1M. Sau phản ứng hoàn toàn, thu được V lít khí Cl2 (đktc) và dd X. a/ Viết phương trình phản ứng xảy ra và tính V? b/ Cho toàn bộ dd X ở trên vào dd AgNO3 dư thu được m gam kết tủa. Tính m?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{Mg}=0,3\left(mol\right)\)
\(n_{HCl}=0,3\left(mol\right)\)
\(PTHH:Mg+2HCl\rightarrow MgCl_2+H_2\)
...............0,15......0,3..........0,15.....0,15......
- Thấy sau phản ứng HCl phản ứng hết, Mg còn dư ( dư 0,15 mol )
\(\Rightarrow\left\{{}\begin{matrix}m_M=m_{MgCl_2}=14,25\left(g\right)\\V=V_{H_2}=3,36\left(l\right)\end{matrix}\right.\)
PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
Ta có: \(n_{Mg}=\dfrac{7,2}{24}=0,3\left(mol\right)\)
\(n_{HCl}=0,2.1,5=0,3\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,3}{2}\), ta được Mg dư.
Theo PT: \(n_{MgCl_2}=n_{H_2}=\dfrac{1}{2}n_{HCl}=0,15\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m_{MgCl_2}=0,15.95=14,25\left(g\right)\\V_{H_2}=0,15.22,4=3,36\left(l\right)\end{matrix}\right.\)
Bạn tham khảo nhé!

Phản ứng:
KClO3 + 6HCl →→ KCl + 3Cl2 ↑ + 3H2O.
![]() 0,1 0,3
0,1 0,3
Sau đó:
118,5gam kết tủa dạng nguyên tố gồm 0,6mol Cl và còn lại là 0,9mol Ag.
Theo đó, số mol AgNO3 là 0,9. Muối (M; NO3) biết khối lượng M là 16,8gam và số mol NO3 là 0,9
→ Lập tỉ lệ 16,8\0,9=56\3 → cho biết kim loại M là Fe

Đáp án D
Ta có: nAxit glutamic = 0,09 mol, nHCl = 0,2 mol
⇒ ∑nCOOH + H+ = 0,09×2 + 0,2 = 0,38 mol.
+ nNaOH = 0,34 mol < ∑nCOOH + H+ = 0,38 mol ⇒ nH2O tạo thành = 0,38 mol.
Bảo toàn khối lượng ta có:
mChất rắn = 13,23 + 0,2×36,5 + 0,4×40 – 0,38×18 = 29,69 gam

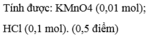
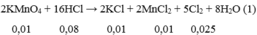


a, \(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+2H_2O\)
Ta có:
\(n_{MnO2}=\frac{4,35}{87}=0,05\left(mol\right)\)
\(n_{HCl}=0,3.1=0,3\left(mol\right)\)
\(n_{Cl2}=n_{MnO2}=0,05\left(mol\right)\)
\(\Rightarrow V_{Cl2}=0,05.22,4=1,12\left(l\right)\)
b,\(MnCl_2+2AgNO_3\rightarrow2AgCl+Mn\left(NO_3\right)_2\)
\(HCl+AgNO_3\rightarrow AgCl+HNO_3\)
\(n_{MnCl2}=n_{MnO2}=0,05\left(mol\right)\)
\(n_{HCl.trong.X}=0,3-0,2=0,1\left(mol\right)\)
\(n_{AgCl}=0,05.2+0,1=0,2\left(mol\right)\)
\(\Rightarrow m_{AgCl}=0,2.143,5=28,7\left(g\right)\)