a) Cần bao nhiêu gam khí oxi để đốt cháy hoàn toàn 3 mol cacbon? 5mol lưu huỳnh?
b) Trong giờ thực hành thí nghiệm, một học sinh đốt cháy 3,2gam lưu huỳnh trong 1,12 lít khí oxi (đktc). Vậy theo em lưu huỳnh cháy hết hay còn dư?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 1:
a) PTHH: C+ O2 -to-> CO2
Theo PTHH và đề bài, ta có:
\(n_{O_2}=n_C=5\left(mol\right)\)
Khối lượng khí O2 cần dùng cho phản ứng:
\(m_{O_2}=n_{O_2}.M_{O_2}=5.32=160\left(g\right)\)
Bài 1 mình không hiểu lắm.
Mình làm bài 2 nha.
Bài 2:
Ta có:
\(n_S=\frac{m_S}{M_S}=\frac{3,2}{32}=0,1\left(mol\right)\)
\(n_{O_2}=\frac{V_{O_2}}{22,4}=\frac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: S + O2 -to-> SO2
Theo PTHH và đề bài ta có:
\(\frac{n_{S\left(đềbài\right)}}{n_{S\left(PTHH\right)}}=\frac{0,1}{1}=0,1>\frac{n_{O_2\left(đềbài\right)}}{n_{O_2\left(PTHH\right)}}=\frac{0,05}{1}=0,05\)
Vậy: O2 phản ứng hết còn S dư .

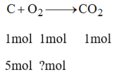
Số mol O 2 :
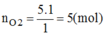
Khối lượng O 2 :
m O 2 = n O 2 . M O 2 = 5.32 = 160(g)
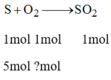
Số mol O 2 :
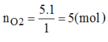
Khối lượng O 2 :
m O 2 = n O 2 . M O 2 = 5.32 = 160(g)

\(a,PTHH:S+O_2\underrightarrow{t^o}SO_2\left(1\right)\)
\(n_S=\dfrac{m}{M}=\dfrac{9,6}{32}=0,3\left(mol\right)\)
\(Theo.PTHH\left(1\right):n_O=n_S=0,3\left(mol\right)\)
\(PTHH:2KClO_3\underrightarrow{t^o}2KCl+3O_2\\ Theo.PTHH\left(2\right):n_{KClO_3}=\dfrac{2}{3}.n_{O_2}=\dfrac{2}{3}.0,3=0,2\left(mol\right)\\ m_{KClO_3}=n.M=0,2.122,5=24,5\left(g\right)\)
\(b,V_{O_2\left(đktc\right)}=n.22,4=0,2.22,4=4,48\left(l\right)\\ \Rightarrow V_{kk\left(đktc\right)}=5.V_{O_2}=5.4,48=22,4\left(l\right)\)

a, PTHH: C + O2 ➝ CO2
Theo pt: 1 1 1 (mol)
Theo bài ra: 5 → 5 (mol)
⇒mO2= 5x32= 160(g)
PTHH: S + O2 ➞ SO2
Theo pt: 1 1 1 (mol)
Theo bài ra: 5 → 5 (mol)
⇔mO2= 5x32=160(g)
b, nO2= 1,12/22,4=0,05(mol)→mO2=1,6(g)
PTHH: S + O2 ➝ SO2
Theo pt: 32 32 64 (g)
Theo bài ra: 3,2 1,6 (g)
Phản ứng: dư hết
⇒mS dư = 3,2 - 1,6=1,6(g)
Vậy lưu huỳnh dư và dư 1,6g
TICK CHO MIK NHOA!!!
a, \(C+O_2\underrightarrow{^{to}}CO_2\)
\(n_{O2}=5\left(mol\right)\rightarrow m_2=160\left(g\right)\)
\(S+O_2\underrightarrow{^{to}}SO_2\)
\(n_{O2}=5\left(mol\right)\rightarrow m_{O2}=160\left(g\right)\)
b, \(n_S=0,1\left(mol\right);n_{O2}=0,05\left(mol\right)\)
Nên S dư 0,05 (mol) \(\rightarrow m_{S_{du}}=1,6\left(g\right)\)

\(n_S=\dfrac{3.2}{32}=0.1\left(mol\right)\)
\(n_{O_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\)
\(S+O_2\underrightarrow{t^0}SO_2\)
\(0.05.0.05...0.05\)
\(\Rightarrow Sdư\)
\(V_{SO_2}=0.05\cdot22.4=1.12\left(l\right)\)
\(b.\)
\(S+O_2\underrightarrow{t^0}SO_2\)
\(0.1..0.1\)
\(V_{kk}=5V_{O_2}=5\cdot0.1\cdot22.4=11.2\left(l\right)\)