Đốt cháy hoàn toàn V lít hiđrocacbon A (mạch hở) thu được 4V lít CO2 và 4V lít hơi nước
(đo trong cùng điều kiện nhiệt độ, áp suất).
a. Xác định CTPT của A.
b. Biết phân tử A có mạch phân nhánh. Xác định CTCT của A.
Bài 2: Đốt cháy hoàn toàn hiđrocacbon A mạch hở thu được số mol CO2 bằng số mol H2O.
a. A thuộc dãy đồng đẳng nào?
b. Biết tỉ khối hơi của A so với metan bằng 4,375. Tìm CTPT của A.
c. Xác định CTCT của A, biết A có đồng phân hình học.
Bài 3: Đốt cháy hoàn toàn 3,36 lít hỗn hợp 2 hiđrocacbon mạch hở liên tiếp nhau trong dãy đồng
đẳng thu được 8,96 lít CO2 và 7,2 gam H2O. Biết các thể tích đều đo ở đktc. Xác định CTPT của
2 hiđrocacbon đó và tính thành phần % về thể tích của từng anken trong hỗn hợp.
K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Những câu hỏi liên quan

21 tháng 3 2023
Ở cùng điều kiện nhiệt độ và áp suất, tỉ lệ số mol cũng là tỉ lệ thể tích.
BTNT O, có: \(V_{O\left(trongA\right)}+2V_{O_2}=2V_{CO_2}+V_{H_2O}\Rightarrow V_{O\left(trongA\right)}=0\)
Vậy: A chỉ gồm C và H.
Gọi CTPT của A là CxHy.
\(\Rightarrow\left\{{}\begin{matrix}x=\dfrac{n_{CO_2}}{n_A}=3\\y=\dfrac{2n_{H_2O}}{n_A}=8\end{matrix}\right.\)
Vậy: CTPT cần tìm là C3H8

7 tháng 6 2018
Pt:
CxHy + (x + 0,25y)O2 → xCO2 + 0,5yH2O
1 → (x + 0,25y) x 0,5y
Thể tích và số mol tỉ lệ thuận nên thể tích bằng nhau thì số mol cũng bằng nhau
Theo đề bài: n(khí trước pứ) = n(khí sau pứ)
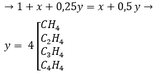
Câu 1 :
A có dạng CxHy
\(C_xH_y+\frac{x+y}{4}O_2\rightarrow xCO_2+\frac{y}{2}H_2O\)
\(\Rightarrow x=\frac{4V}{V}=4;y=\frac{4V.2}{V}=8\)
Vậy A là C4H8
CTCT của A là CH2=C(CH3)-CH3 (nhánh)
Câu 2 :
Đốt A cho số mol CO2 bằng số mol H2O
\(\Rightarrow\) A có dạng CnH2n (anken hoặc xicloankan)
\(C_nH_{2n}+1,5nO_2\rightarrow nCO_2+nH_2O\)
\(M_A=14n=4,575M_{CH4}=4,375.16=70\)
\(\Rightarrow n=5\Rightarrow\) A là C5H10
Vậy CTCT của A là CH3-CH=CH-CH2-CH3
Câu 3 :
n hỗn hợp hidrocacbon=\(\frac{3,36}{22,4}=0,15\left(mol\right)\)
\(hidrocabon+O_2\rightarrow CO_2+H_2O\)
Ta có: \(n_{CO2}=\frac{8,96}{22,4}=0,4\left(mol\right);n_{H2O}=\frac{72}{18}=0,4\left(mol\right)\)
\(\Rightarrow n_{H2O}=n_{CO2}\)
\(\Rightarrow\) Hỗn hợp 2 hidrocacbon có dạng CnH2n
\(\Rightarrow n=\frac{0,4}{0,15}=2,67\)
\(\Rightarrow\) 2 hidrocacbon là C2H4 x mol và C3H6 y mol
\(\left\{{}\begin{matrix}x+y=0,15\\2x+3y=0,4\Rightarrow\end{matrix}\right.\left\{{}\begin{matrix}x=0,05\\y=0,1\end{matrix}\right.\)
Vì % số mol = % thể tích
\(\%_{C2H4}=\frac{0,05}{0,15}=33,33\%\Rightarrow\%V_{C3H6}=66,67\%\)