Cho 11.3g hỗn hợp Mg và Zn tác dụng vừa đủ với dung dịch HCl thu được 6,72 lít khí H2 (đktc). Tính % kim loại trong hỗn hợp đầu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


1.1. Al + NaOH + H2O ==> NaAlO2 + 3/2H2
nH2(1)=3,36/22,4=0.15(mol)
=> nAl(1)= nH2(1):3/2= 0.15:3/2= 0.1(mol)
2.Mg + 2HCl ==> MgCl2 + H2
3.2Al + 6HCl ==> 2AlCl3 + 3H2
4.Fe + 2HCl ==> FeCl2 + H2
=> \(n_{H_2\left(2,3,4\right)}=\) 10.08/22.4= 0.45(mol)
=> nH2(3)=0.1*3/2=0.15(mol)
MgCl2 + 2NaOH ==> Mg(OH)2 + 2NaCl
AlCl3 + 3NaOH ==> Al(OH)3 + 3NaCl
FeCl2 + 2NaOH ==> Fe(OH)2 + 2NaCl

nH2 = 6.72/22.4=0.3 mol
a) đặt x,y lần lượt là số mol của Zn và Fe
pt: Zn +2HCl --> ZnCl2 + H2 (1)
x x/2 x x
Fe + 2HCl --> FeCl2 + H2 (2)
y y/2 y y
Ta có hệ phương trình: 65x + 56y =18.6
x +y =0.3
giải hệ trên ta có :x=0.2 ;y=0.1
Thay vào pt, ta tính được mZn = 0.2*65=13g
mFe= 0.1*56=5.6g
c)C1: dựa theo pthh
mZnCl2= 0.2*136=27.2g
mFeCl2= 0.1*127=25.4g
C2: tính theo bảo toàn khối lượng
-tính mHcl và mH2
-tổng chất sản phẩm - mH2
b) anh không rõ a là gì nên em hỏi lại lại thầy nha

CR ko tan là Cu
mCu= 12,8 (g)
\(\Rightarrow\) mMg + mFe = 23,6 - 12,8 = 10,8 (g)
Gọi nMg=x , nFe=y trong 10,8 g
\(\Rightarrow\) 24x + 56y = 10,8 (l)
Mg + 2HCl \(\rightarrow\) MgCl2 + H2
x ----> 2x (mol)
Fe + 2HCl \(\rightarrow\) FeCl2 + H2
y ----> 2y (mol)
nHCl = \(\frac{91,25.20\%}{36,5}\) = 0,5 (mol)
\(\Rightarrow\) 2x + 2y = 0,5 (ll)
Từ (l) và (ll) \(\Rightarrow\) \(\begin{cases}x=0,1\\y=0,15\end{cases}\)
mMg = 0,1 . 24 =2,4 (g)
mFe = 8,4 (g)

`Fe + 2HCl -> FeCl_2 + H_2↑`
`0,3` `0,6` `0,3` `0,3` `(mol)`
`n_[H_2] = [ 6,72 ] / [ 22,4 ] = 0,3 (mol)`
`-> m_[Fe] = 0,3 . 56 = 16,8 (g)`
`-> m_[FeCl_2] = 0,3 . 127 = 38,1 (g)`
`b) C_[M_[HCl]] = [ 0,6 ] / [ 0,3 ] = 2 (M)`
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: Fe + 2HCl ---> FeCl2 + H2
0,3<---0,6<------0,3<-----0,3
=> \(\left\{{}\begin{matrix}m_{Fe}=0,3.56=16,8\left(g\right)\\m_{FeCl_2}=127.0,3=38,1\left(g\right)\\C_{M\left(HCl\right)}=\dfrac{0,6}{0,3}=2M\end{matrix}\right.\)

a,
\(n_{H2}=0,35\left(mol\right)\)
\(n_{HCl}=2n_{H2}=0,7\left(mol\right)\)
\(\Rightarrow m_{dd_{HCl}}=0,7.36,5:15\%=170,33\left(g\right)\)
b,
Gọi a là mol Mg, b là mol Al
\(\Rightarrow24a+27b=7,5\left(1\right)\)
Bảo toàn e: \(2a+3b=0,35.2=0,7\left(2\right)\)
\(\left(1\right)+\left(2\right)\Rightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\)
\(\Rightarrow\%_{Mg}=\frac{0,2.24}{7,5}.100\%=64\%\)
\(\Rightarrow\%_{Al}=100\%-64\%=36\%\)

Đáp án B
Ta có:
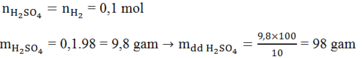
Áp dụng định luật bảo toàn khôi lượng:
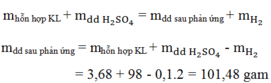

n H2=6,72/22,4=0,3(mol)
Gọi n Mg=x, n Zn=y
-->24x+65y=11,3(1)
Mg+2HCl--->MgCl2+H2
x----------------------------x(mol)
Zn+2HCl--->ZnCl2+H2
y------------------------y(mol)
x+y=0,3(2)
từ 1 và 2 ta có hpt
\(\left\{{}\begin{matrix}24x+65y=11,3\\x+y=0,3\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
%m Mg=0,2.24/11,3.100%=42,48%
%m Zn=100%-42,48=57,52%