cho 30,6g hỗn hợp X gồm Cu và Fe3O4 tác dụng với 500ml đung dịch HNO3 loãng, đun nóng và khuấy đều. Sau khi phản ứng sảy ra hoàn toàn , thu được 1,68 lít khí NO( sản phẩm khử duy nhất ở đktc), dung dịch Y và còn lại 1,2g kim loại.
a, Viết phương trình phản ứng sảy ra.
b, tính nồng độ mol của axit HNO3

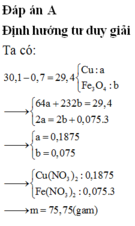

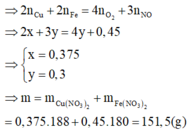

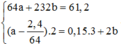
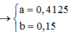
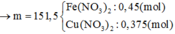
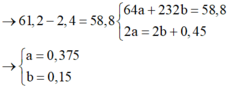
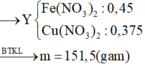
a,
\(3Cu+8HNO_3\rightarrow3Cu\left(NO_3\right)_2+2NO+4H_2O\)
\(3Fe_3O_4+28HNO_3\rightarrow9Fe\left(NO_3\right)_3+NO+12H_2O\)
\(Cu+2Fe\left(NO_3\right)_3\rightarrow Cu\left(NO_3\right)_2+2Fe\left(NO_3\right)_2\)
b,
Vì dư Cu nên Fe3+ đã bị khử hết xuống Fe2+. Muối spu gồm Cu(NO3)2, Fe(NO3)2.
\(m_{X_{pu}}=30,6-1,2=29,4\left(g\right)\)
Gọi a là mol Cu; b là mol Fe3O4
\(\rightarrow64a+232b=29,4\left(1\right)\)
\(n_{NO}=0,075\left(mol\right)\)
Fe3O4 gồm 3b mol Fe; 4b mol O
Cu lên +2, Fe lên +2
Bảo toàn e:
\(2a+6b=0,075.2+8b\)
\(\Leftrightarrow2a-2b=0,225\left(2\right)\)
\(\left(1\right)+\left(2\right)\rightarrow\left\{{}\begin{matrix}a=0,1875\\b=0,075\end{matrix}\right.\)
nHNO3= 2nCu(NO3)2+ 2nFe(NO3)2+ nNO= 0,6 mol
\(\rightarrow CM_{HNO3}=1,2M\)
Số e nhận của N là 3 sao nhân 2